Αντίδραση Ντιλς-Άλντερ
Η αντίδραση Ντιλς-Άλντερ (ΝΑ) (Diels–Alder reaction) είναι μια οργανική αντίδραση (ειδικότερα, μια [4+2] κυκλοπροσθήκη (cycloaddition)) μεταξύ ενός συζυγούς αλκαδιενίου και ενός υποκατεστημένου αλκενίου, που συνήθως ονομάζεται το διενόφιλο, για να σχηματίσει ένα υποκατεστημένο σύστημα κυκλοεξενίου. Πρωτοπεριγράφτηκε από τους Ότο Ντίλς και Κουρτ Άλντερ το 1928 και για αυτή την εργασία τους τιμήθηκαν με το βραβείο Νόμπελ το 1950.[1][2][3][4] Η αντίδραση Ντιλς-Άντλερ είναι ιδιαίτερα χρήσιμη στην συνθετική οργανική χημεία ως μια αξιόπιστη μέθοδος σχηματισμού εξαμελών συστημάτων με καλό έλεγχο τοπικών και στερεοχημικών ιδιοτήτων.[5][6][7] Η έννοια αυτή έχει επίσης εφαρμοστεί σε άλλα συστήματα π, όπως στα καρβονύλια και τις ιμίνες, για να δώσουν τις αντίστοιχες ετεροκυκλικές ενώσεις, γνωστή ως η ετεροαντίδραση Ντιλς-Άλντερ (hetero-Diels–Alder reaction). Οι αντιδράσεις Ντιλς-Άλντερ μπορεί να είναι αντιστρεπτές κάτω από συγκεκριμένες συνθήκες· η αντίστροφη αντίδραση είναι γνωστή ως αντίστροφη αντίδραση Ντιλς-Άλντερ (retro-Diels–Alder reaction).[8]

Ο μηχανισμός της αντίδρασης
[Επεξεργασία | επεξεργασία κώδικα]Η αντίδραση είναι ένα παράδειγμα μιας συντονισμένης περικυκλικής αντίδρασης (concerted pericyclic reaction).[9] Πιστεύεται ότι λαμβάνει χώρα μέσω μιας μοναδικής, κυκλικής μεταβατικής κατάστασης,[10] χωρίς τη δημιουργία ενδιαμέσων προϊόντων κατά τη διάρκεια της πορείας της αντίδρασης. Ως τέτοια, η αντίδραση Ντιλς-Άντλερ διέπεται από μελέτες τροχιακής συμμετρίας: ταξινομείται ως μια [4πS+2πS] κυκλοπροσθήκη, που δείχνει ότι προχωράει μέσω της συνμετωπικής (suprafacial)/συνμετωπικής αλληλεπίδρασης ενός συστήματος 4π ηλεκτρονίου με ένα σύστημα 2π ηλεκτρονίου, μια αλληλεπίδραση που επιτρέπεται θερμικά ως μια κυκλοπροσθήκη 4n+2.[11]
Μια μελέτη των συνοριακών μοριακών τροχιακών (frontier molecular orbitals) (FMO) των αντιδρώντων ερμηνεύει γιατί συμβαίνει αυτό. Σημειώνουμε ότι για μια ‘κανονική’ ηλεκτρονική απαίτηση στην αντίδραση Ντιλς-Άλντερ, το ηλεκτρονικά πλούσιο Ψ2 του διενίου είναι το υψηλότερα κατειλημμένο μοριακό τροχιακό (highest occupied molecular orbital ή HOMO), ενώ το φτωχό ως προς ηλεκτρόνια π* του διενοφίλου είναι το χαμηλότερο μη κατειλημμένο μοριακό τροχιακό (lowest unoccupied molecular orbital ή LUMO). Όμως, το ενεργειακό χάσμα μεταξύ HOMO-LUMO είναι τέτοιο που οι ρόλοι μπορεί να αντιστραφούν εναλλάσσοντας το μοτίβο υποκατάστασης: δηλαδή, το Ψ3 του διενίου μπορεί να θεωρηθεί ως το LUMO αν υποκαταστάτες της ομάδας δέκτη ηλεκτρονίων (electron withdrawing group ή EWG) το κάνουν αρκετά φτωχό ηλεκτρονικά και οι ομάδες δότες ηλεκτρονίων (electron donating groups ή EDGs) αυξήσουν επαρκώς την ενέργεια του συμπληρωμένου π τροχιακού του διενοφίλου για να το κάνουν HOMO. Ένα τέτοιο σενάριο ορίζεται ως μια αντίδραση Ντιλς-Άλντερ αντίστροφης ηλεκτρονικής απαίτησης. Ανεξάρτητα από το σε ποια κατάσταση ανήκουν, τα HOMO και LUMO των συστατικών είναι σε φάση και μια δεσμική αλληλεπίδραση καταλήγει όπως μπορεί να ιδωθεί στο παρακάτω διάγραμμα. Επειδή τα αντιδρώντα είναι στη βασική κατάσταση, η αντίδραση ξεκινά θερμικά και δεν απαιτεί ενεργοποίηση από το φως.[11]

Η «ισχύουσα άποψη»[12][13][14][15] είναι ότι οι περισσότερες αντιδράσεις Ντιλς-Άλντερ προχωρούν μέσω ενός συντονισμένου μηχανισμού το θέμα, όμως έχει αμφισβητηθεί πλήρως. Παρά το γεγονός ότι η μεγάλη πλειοψηφία των αντιδράσεων Ντιλς-Άλντερ εμφανίζονται στερεοειδικές, η προσθήκη συν των δύο συστατικών, ένα διριζικό (diradical) ενδιάμεσο έχει προταθεί[10] (και υποστηρίζεται με υπολογιστικές ενδείξεις) με βάση το ότι η παρατηρούμενη στερεοεξειδίκευση δεν αποκλείει μια προσθήκη δύο σταδίων που περιλαμβάνει ένα ενδιάμεσο που μετατρέπεται σε προϊόν πιο γρήγορα από ότι μπορεί να περιστραφεί για να επιτρέψει την αντιστροφή της στερεοχημείας.
Υπάρχει μια σημαντική βελτίωση απόδοσης όταν κάποιες αντιδράσεις Ντιλς-Άλντερ εκτελούνται στο νερό,[16] καθώς και σε άλλους πολικούς διαλύτες όπως το διμεθυλοφορμαμίδιο και η αιθυλενογλυκόλη.[17] Η αντίδραση του κυκλοπενταδιενίου και της βουτενόνης για παράδειγμα είναι 700 φορές πιο γρήγορη στο νερό σχετικά με το 2,2,4-τριμεθυλοπεντάνιο.[16] Αρκετές εξηγήσεις για αυτό το φαινόμενο έχουν προταθεί, όπως μια αύξηση στην αποτελεσματική συγκέντρωση λόγω της υδρόφοβης πλήρωσης[18] ή της σταθεροποίησης του δεσμού υδρογόνου της μεταβατικής κατάστασης.[19]
Τοποεπιλεκτικότητα
[Επεξεργασία | επεξεργασία κώδικα]Η ανάλυση FMO έχει επίσης χρησιμοποιηθεί για να εξηγήσει τα παρατηρούμενα μοτίβα τοποεπιλεκτικότητας στις αντιδράσεις Ντιλς-Άλντερ των υποκατεστημένων συστημάτων. Ο υπολογισμός της ενέργειας και των συντελεστών τροχιακών των συνοριακών τροχιακών των συστατικών[20] δίνει μια εικόνα που συμφωνεί καλά με την πιο ευθεία ανάλυση των φαινομένων συντονισμού των υποκαταστατών. Αν θεωρήσουμε ότι τα κέντρα με τους μεγαλύτερους συντελεστές συνοριακών τροχιακών θα αντιδράσουν πιο εύκολα όταν ταιριάζουν παρά το αντίθετο (δηλαδή ο μέγιστος συντελεστής HOMO θα αντιδράσει πιο εύκολα με τον μέγιστο συντελεστή LUMO), μπορούμε να προβλέψουμε εύκολα το κύριο ισομερές θέσης που θα καταλήξει από ένα δεδομένο ζεύγος διένιου-διενόφιλου.[11]

Παραδείγματος χάρη, σε ένα σενάριο κανονικής απαίτησης, ένα διένιο που φέρει ένα EDG στο C1 έχει τον μέγιστο του συντελεστή HOMO στο C4, ενώ το διενόφιλο έχει τον μέγιστο συντελεστή LUMO στο C2. Η σύζευξη αυτών των δύο συντελεστών δίνει το «όρθο» προϊόν όπως φαίνεται στην περίπτωση 1 στην παρακάτω εικόνα. Ένα διένιο υποκατεστημένο στο C2 όπως στην περίπτωση 2 παρακάτω έχει τον μέγιστο συντελεστή HOMO στο C1, οδηγώντας στο «πάρα» προϊόν. Παρόμοιες αναλύσεις για τα αντίστοιχα σενάρια αντίστροφης απαίτησης οδηγούν σε ανάλογα προϊόντα όπως φαίνεται στις περιπτώσεις 3 και 4.
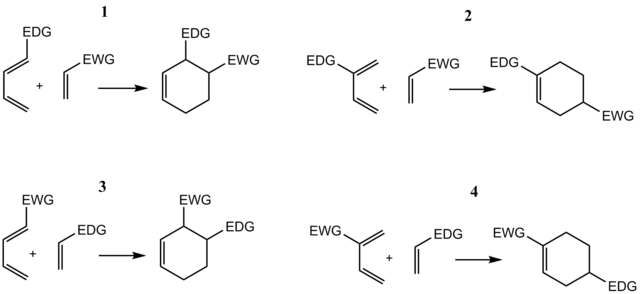
.
Στερεοεπιλεκτικότητα
[Επεξεργασία | επεξεργασία κώδικα]Οι αντιδράσεις Ντιλς-Άλντερ, ως συντονισμένες κυκλοπροσθήκες, είναι στερεοειδικές, δηλαδή οι στερεοχημικές πληροφορίες στα αντιδρώντα διατηρούνται στα προϊόντα. E- και Z-διενόφιλα, παραδείγματος χάρη, οδηγούν σε σύμπλοκα με αντίστοιχη συν (syn) ή αντί (anti)-στερεοχημεία:[21][22]

Ασύμμετρα διενόφιλα συνεπάγονται δύο διαφορετικές πιθανές μεταβατικές καταστάσεις, που λέγονται ένδο (endo) και έξω (exo) καταστάσεις μετάβασης, που η καθεμιά της οδηγεί σε σύμπλοκα διαφορετικής στερεοχημείας. Στην ένδο κατάσταση μετάβασης, ο υποκαταστάτης στο διενόφιλο προσανατολίζεται προς το διενικό σύστημα π, ενώ στην έξω προσανατολίζεται μακριά από αυτό. Για σενάρια κανονικής απαίτησης Ντιλς-Άλντερ, με υποκαταστάτες που απομακρύνουν ηλεκτρόνια όπως σε καρβονύλια προσδεδεμένα στο διενόφιλο, η κατάσταση ένδο μετάβασης προτιμάται συνήθως, αν και συχνά είναι πιο στερεοχημικά γεμάτη. Αυτή η προτίμηση είναι γνωστή ως ο κανόνας Άλντερ (Alder rule). Η ένδο επιλεκτικότητα είναι συνήθως υψηλότερη για συμπαγή διενόφιλα όπως ο μηλεϊνικός ανυδρίτης και η βενζοκινόνη· για άλλες ενώσεις, όπως οι ακρυλικές και οι κροτωνικές, η επιλεκτικότητα δεν εκφράζεται πολύ.[23] Η πιο πλατιά αποδεκτή εξήγηση για την προέλευση αυτού του φαινομένου είναι μια προτιμώμενη αλληλεπίδραση μεταξύ του π συστήματος του διενοφίλου υποκαταστάτη και του διενίου (με τον όρο δευτεροταγή τροχιακά φαινόμενα (secondary orbital effects)), αν και διπολικές έλξεις καθώς και δυνάμεις Βαν Ντερ Βάαλς μπορεί να παίζουν ρόλο επίσης.[9][24][25]
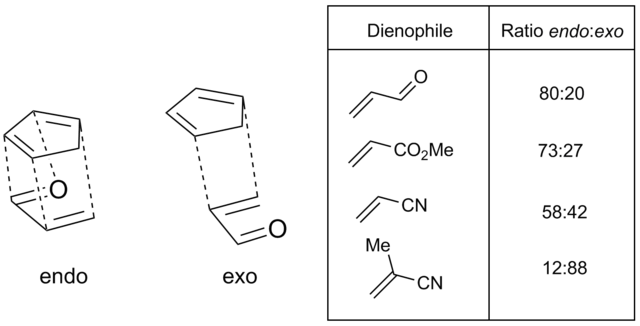
Συχνά, όπως με τα πολύ υποκατεστημένα διένια ή τα πολύ ογκώδη διενόφιλα, τα στερεοχημικά φαινόμενα μπορούν να επηρεάσουν πολύ την ένδο/έξω επιλεκτικότητα. Τα διενόφιλα με ογκώδεις τελικούς υποκαταστάτες (C1 και C4) μειώνουν τον βαθμό της αντίδρασης, πιθανόν εμποδίζοντας την προσέγγιση του διενίου και του διενοφίλου[26] όμως, ογκώδεις υποκαταστάτες στη θέση C2 ή C3 στην πραγματικότητα αυξάνουν τον βαθμό της αντίδρασης αποσταθεροποιώντας την s-trans διαμόρφωση και εξαναγκάζοντας το διένιο στην δραστική s-cis διαμόρφωση. Παραδείγματος χάρη, το 2-tert-βουτυλο-1,3-βουταδιένιο, είναι is 27 φορές πιο δραστικό από το απλό βουταδιένιο.[9][27]
Το διένιο
[Επεξεργασία | επεξεργασία κώδικα]Το διένιο της αντίδρασης Ντιλς-Άλντερ μπορεί να είναι είτε ανοιχτής αλυσίδας είτε κυκλικής και μπορεί να δεχθεί ως ξενιστές πολλούς διαφορετικούς τύπους υποκαταστατών·[9] πρέπει, όμως, να μπορεί να υπάρχει στη s-cis διαμόρφωση, επειδή αυτή είναι το μόνο διαμορφομερές που μπορεί να συμμετάσχει στην αντίδραση. Αν και τα βουταδιένια προτιμούν συνήθως την s-trans διαμόρφωση, για τις περισσότερες περιπτώσεις το φράγμα περιστροφής είναι μικρό (~2–5 kcal/mol).[28]
Ένα εξαιρετικά δραστικό διένιο είναι το 1-μεθοξυ-3-τριμεθυλοσιλοξυ-1,3-βουταδιένιο (1-methoxy-3-trimethylsiloxy-1,3-butadiene), γνωστό και ως διένιο Ντανισέφσκι.[29] Έχει ιδιαίτερη συνθετική χρησιμότητα ως μέσο παροχής συστημάτων α,β–ακόρεστης κυκλοεξενόνης με αφαίρεση του 1-μεθοξυ υποκαταστάτη μετά την αποπροστασία του ενολοσιλυλο αιθέρα (enol silyl ether). Άλλα συνθετικά χρήσιμα παράγωγα του διενίου Ντανισέφσκι περιλαμβάνουν 1,3-αλκοξυ-1-τριμεθυλοσιλοξυ-1,3-βουταδιένια (1,3-alkoxy-1-trimethylsiloxy-1,3-butadienes ή διένια Μπρασάρ (Brassard dienes))[30] και 1-διαλκυλοαμινο-3-τριμεθυλοσιλοξυ-1,3-βουταδιένια (1-dialkylamino-3-trimethylsiloxy-1,3-butadienes ή διένια Ράουαλ (Rawal dienes)).[31] Η αυξημένη δραστικότητα αυτών και παρόμοιων διενίων είναι αποτέλεσμα των συνεργειακών συνεισφορών από δότες ομάδων στα C1 και C3, αυξάνοντας το HOMO σημαντικά πάνω από αυτό ενός παρεμφερούς μονοϋποκατεστημένου διενίου.[7]

Ασταθή (και συνεπώς πολύ δραστικά) διένια, από τα οποία ίσως τα πιο χρήσιμα συνθετικά είναι τα o-κινοδιμεθάνια, μπορούν να παραχθούν in situ.[32] Μια ισχυρή κατευθυντήρια δύναμη για την [4+2] κυκλοπροσθήκη τέτοιων ειδών είναι αποτέλεσμα της δημιουργίας (ή επαναδημιουργίας) της αρωματικότητας. Οι συνηθισμένες μέθοδοι δημιουργίας o-κινοδιμεθανίων περιλαμβάνουν την πυρόλυση των βενζοκυκλοβουτενίων[9] ή της αντίστοιχης σουλφόνης,[7] 1,4-απόσπασης των ορθοβενζυλικών σιλανίων[33] ή κασσιτερανίων (stannanes),[34][35][36] και αναγωγής των α,α’-ορθοβενζυλικών διβρωμιδίων.[37]
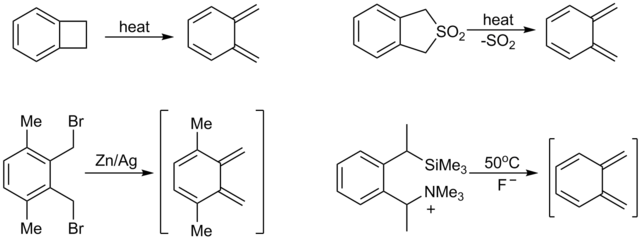
Το διενόφιλο
[Επεξεργασία | επεξεργασία κώδικα]Σε μια αντίδραση normal demand Ντιλς-Άλντερ, το διενόφιλο έχει μια ομάδα που απωθεί ηλεκτρόνια σε συνδυασμό με το αλκένιο· σε ένα σενάριο inverse-demand, το διενόφιλο συνδυάζεται με μια ομάδα δότη ηλεκτρονίων.[12] Τα διενόφιλα μπορούν να επιλεγούν να περιέχουν μια "masked functionality". Το διενόφιλο υφίσταται μια αντίδραση Ντιλς-Άλντερ με ένα διένιο εισάγοντας μια τέτοια λειτουργικότητα στο μόριο του προϊόντος. Μια σειρά αντιδράσεων ακολουθούν έπειτα για να μετασχηματίσουν τη λειτουργικότητα σε μια επιθυμητή ομάδα. Το τελικό προϊόν δεν μπορεί να παρασκευαστεί σε ένα μοναδικό βήμα DA, επειδή ισοδύναμα διενόφιλα είναι είτε μη δραστικά είναι απρόσιτα. Ένα παράδειγμα μιας τέτοιας προσέγγισης είναι η χρήση του α-χλωροακρυλονιτριλίου (CH2=CClCN). Όταν αντιδρά με ένα διένιο, αυτό το διενόφιλο θα εισάγει μια λειτουργικότητα α-χλωρονιτριλίου στο μόριο του προϊόντος. Αυτό είναι μια "masked functionality" που μπορεί έπειτα να υδρολυθεί για να σχηματίσει μια κετόνη. Το διενόφιλο α-χλωροακρυλονιτρίλιο είναι ένα ισοδύναμο του διενόφιλου ketene (CH2=C=O), το οποίο θα παρήγαγε το ίδιο προϊόν σε ένα βήμα ΝΑ. Το πρόβλημα είναι ότι το ίδιο το κετένιο δεν μπορεί να χρησιμοποιηθεί στις αντιδράσεις ΝΑ, επειδή αντιδρά με διένια κατά ανεπιθύμητο τρόπο (με [2+2] κυκλοπροσθήκη) και συνεπώς πρέπει να χρησιμοποιηθεί η προσέγγιση "masked functionality".[38] Άλλες τέτοιες ενώσεις είναι υποκατάστατα του φωσφονίου (που δίνουν εξωκυκλικούς διπλούς δεσμούς μετά την αντίδραση Βίτιχ (Wittig)), διάφορα σουλφοξείδια και σουλφονύλια (και τα δύο είναι ισοδύναμα του ακετυλενίου) και νιτρομάδες (ισοδύναμα κετενίου).[9]
Έτερο-Ντιλς-Άλντερ
[Επεξεργασία | επεξεργασία κώδικα]Οι αντιδράσεις Ντιλς-Άλντερ που περιλαμβάνουν τουλάχιστον ένα ετεροάτομο είναι επίσης γνωστές και καλούνται συλλογικά αντιδράσεις έτερο-Ντιλς-Άλντερ.[39] Οι καρβονυλομάδες, παραδείγματος χάρη, μπορούν να αντιδράσουν επιτυχώς με διένια ώστε να δώσουν πυρανοειδείς δακτυλίους, μια αντίδραση γνωστή ως η οξοαντίδραση Ντιλς-Άλντερ (oxo-Diels–Alder reaction) και οι ιμίνες έχουν επίσης χρησιμοποιηθεί επιτυχώς ως διενόφιλα· τέτοιες αντιδράσεις είναι γνωστές ως αζωτοαντιδράσεις Ντιλς-Άλντερ (aza-Diels–Alder reactions) και αποδεικνύονται χρήσιμες για την παρασκευή των αλκαλοειδών και άλλων Ν-ετεροκυκλικών ενώσεων.[40] Οι νιτρωδοενώσεις (R-N=O) μπορούν να αντιδράσουν με διένια για να σχηματίσουν οξαζίνες. Το ισοκυανικό χλωροσουλφονύλιο μπορεί να χρησιμοποιηθεί ως διενόφιλο για να παρασκευαστεί η λακτάμη Βινς.[9][40]
Ενεργοποίηση οξέος Λιούις
[Επεξεργασία | επεξεργασία κώδικα]Οξέα Λιούις όπως ο χλωριούχος ψευδάργυρος, το τριφθοριούχο βόριο, ο τετραχλωριούχος ψευδάργυρος, το χλωριούχο αργίλιο κλπ. μπορούν να δράσουν ως καταλύτες των αντιδράσεων Ντιλς-Άλντερ κανονικής απαίτησης σε συντονισμό με το διενόφιλο. Το συμπλοκοποιημένο διενόφιλο γίνεται πιο ηλεκτρόφιλο και πιο δραστικό προς το διένιο, αυξάνοντας τον ρυθμό της αντίδρασης και βελτιώνοντας συχνά την τοποεπιλεκτικότητα και την στερεοεπιλεκτικότητα, επίσης. Η κατάλυση με οξέα Λιούις ενεργοποιεί επίσης τις αντιδράσεις Ντιλς-Άλντερ ώστε να προχωρήσουν σε χαμηλές θερμοκρασίες, δηλαδή χωρίς θερμική ενεργοποίηση.[9]
Ασύμμετρη Ντιλς-Άλντερ
[Επεξεργασία | επεξεργασία κώδικα]Πολλές μέθοδοι έχουν αναπτυχθεί για να επηρεάσουν την στερεοεπιλεκτικότητα της αντίδρασης Ντιλς-Άλντερ, όπως η χρήση εντιομερών βοηθητικών και η κατάλυση από εναντιομερή οξέα Λιούις ή μικρά οργανικά μορία.[9] Οξαζολιδινόνες του Evans,[41] οξαζαβορολιδίνες (oxazaborolidines),[42][43][44] δις-οξαζολίνη χηλικά χαλκού (bis-oxazoline Cu-chelates),[45] κατάλυση ιμιδαζολίνης,[46] και πολλές άλλες μεθοδολογίες επηρεάζουν την διαστερεοεπιλεκτικότητα και την εναντιοεπιλεκτικότητα των αντιδράσεων Ντιλς-Άλντερ.
Συνθετικές εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Ένα από τα πρώτα και πιο σημαντικά παραδείγματα της αντίδρασης Ντιλς-Άλντερ στην συνολική σύνθεση ήταν από τον Woodward κ.α. συνθέσεις των στεροειδών κορτιζόνη και χοληστερόλη.[47] Η παρακάτω αντίδραση του βουταδιενίου με την κινόνη προμήθευσε γρήγορα τους C και D δακτυλίους του στεροειδούς σκελετού με την επιθυμητή τοποχημεία. Η προσθήκη συν του βουταδιενίου οδήγησε στην επιθυμητή στερεοχημεία της μεθυλομάδας του τελικού στόχου και κατόπιν ενός ευθέως επιμερισμού μπορούσε να επηρεαστεί επιλεκτικά για να δώσει το αναγκαίο σύστημα trans-δεκαλίνης.

Ο E.J. Corey, στην αρχική του σύνθεση των προσταγλανδινών (prostaglandins) F2α και E2, το 1969,[48] χρησιμοποίησε μια αντίδραση Ντιλς-Άλντερ νωρίς στη σύνθεση για να πραγματοποιήσει τη σχετική στερεοχημεία τριών γειτονικών στερεοκέντρων στον πυρήνα κυκλοπεντανίου της προσταγλανδίνης. Για να μετριάσει τον ισομερισμό του υποκατεστημένου κυκλοπενταδιενίου μέσω μετατόπισης 1,5-υδριδίου (1,5-hydride shift), βρέθηκε ότι είναι απαραίτητη η διατήρηση αυτού του ενδιάμεσου κάτω από τους 0 °C μέχρι να μπορέσει η Ντιλς-Άλντερ να λάβει χώρα. Έτσι απαιτήθηκε η ενεργοποίηση από ισχυρά όξινο κατά Λιούις τετραφθοροβορικού χαλκού (cupric tetrafluoroborate) για να επιτραπεί στην αντίδραση να γίνει. Η χρήση του 2-χλωροακρυλονιτριλίου ως διενοφίλου είναι αξιοσημείωτη ως ενός συνθετικού ισοδύναμου του κετενίου,[12] που δεν συμμετέχει στις αντιδράσεις Ντιλς-Άλντερ με 1,3-διένια, αλλά μπορεί να υποβληθεί σε μια [2+2] κυκλοπροσθήκη για να δώσει μια κυκλοβουτανόνη.[49][50] Η υδρόλυση του επιμερικού μείγματος των συμπλόκων χλωρονιτριλίου αποκάλυψε την επιθυμητή δικυκλοεπτανόνη σε υψηλή απόδοση.

Ο Ντανισέφσκι (S. Danishefsky) χρησιμοποίησε μια αντίδραση Ντιλς-Άλντερ για να συνθέσει προφαινικό δινάτριο (disodium prephenate),[51] μια βιοσυνθετική πρόδρομη ένωση των αμινοξέων φαινυλαλανίνης και τυροσίνης, το 1979. Αυτή η σειρά είναι αξιοσημείωτη ως μία από τις πρώτες που χαρακτηρίζουν το 1-μεθοξυ-3-σιλοξυβουταδιένιο (1-methoxy-3-siloxybutadiene), το επονομαζόμενο διένιο Ντανισέφσκι, στην ολική σύνθεση. Η χρησιμότητα του είναι φανερή παρακάτω, συγκεκριμένα, στην απευθείας παραγωγή των συστημάτων α,β–ακόρεστων συστημάτων κυκλοεξενόνης.

Στη σύνθεσή της ρεζερπίνης (reserpine) ο Wender και οι συνεργάτες του, το 1980,[52] χρησιμοποίησαν μια αντίδραση Ντιλς-Άλντερ για να ορίσουν τον σκελετό της cis-δεκαλίνης των δακτυλίων D και E του φυσικού προϊόντος. Η αρχική αντίδραση Ντιλς-Άλντερ μεταξύ του 2-ακετοξυακρυλικού οξέος και του 1,2-διυδροπυριδινο-1-καρβοξυλικού (1,2-dihydropyridine-1-carboxylate) που φαίνεται παρακάτω έβαλε την νεοεγκατεστημένη καρβοξυλομάδα σε μια θέση για αποκλειστική αναδιάταξη προς τους cis συγχωνευμένους δακτυλίους μετά τη μετατροπή στην παρακάτω εμφανιζόμενη isoquinuclidene. Η cis συγχώνευση επέτρεψε την επίτευξη της στερεοχημείας στους C17 και C18: πρώτα με διάσπαση της οξικής ομάδας στον C18 για να δώσει μια κετόνη που μπορεί να διαμορφώσει τη στερεοχημεία της μεθοξυομάδας C17 και έπειτα με αναγωγή της κετόνης στον C18 από την έξω πλευρά (exo face) για την επίτευξη της στερεοχημείας του τελικού προϊόντος.

Στη σύνθεση της ρεζερπίνης από τον S.F. Martin,[53] οι cis συγχωνευμένοι D και E δακτύλιοι σχηματίστηκαν επίσης από μια αντίδραση Ντιλς-Άλντερ. Η ενδομοριακή αντίδραση Ντιλς-Άλντερ της πυρανόνης παρακάτω με την επακόλουθη εξώθηση του διοξειδίου του άνθρακα μέσω μιας αντίστροφης [4+2] παρήγαγε τη δικυκλική λακτάμη. Η εποξείδωση (Epoxidation) από τη λιγότερο παρεμποδιζόμενη α-πλευρά, ακολουθούμενη από το εποξειδικό άνοιγμα στη λιγότερο παρεμποδιζόμενη C18 πέτυχε την επιθυμητή στερεοχημεία σε αυτές τις θέσεις, ενώ η cis συγχώνευση επετεύχθη με υδρογόνωση, που προχώρησε κυρίως πάλι από την λιγότερο εμποδιζόμενη πλευρά.

Μια πυρανόνη χρησιμοποιήθηκε παρομοίως ως το διενόφιλο από την ομάδα Νικολάου στην ολική σύνθεση της ταξόλης.[54] Η διαμοριακή αντίδραση της υδροξυπυρόνης και του α,β–ακόρεστου εστέρα που φαίνεται παρακάτω υπέφερε από χαμηλή απόδοση και τοποεπιλεκτικότητα· όμως, όταν κατευθύνθηκε από το φαινυλβορονικό οξύ[55] το επιθυμητό σύμπλοκο μπόρεσε να ληφθεί σε απόδοση 61% μετά τη διάσπαση του βορονικού με τη 2,2-διμεθυλο-1,3-προπανοδιόλη. Η στερεοεξειδίκευση της αντίδρασης Ντιλς-Άλντερ σε αυτήν την περίπτωση επέτρεψε τον ορισμό των τεσσάρων στερεοκέντρων που που μεταφέρθηκαν στο τελικό προϊόν.

Μια αντίδραση Ντιλς-Άλντερ ήταν το βασικό βήμα στη σύνθεση of (-)-φουρακινοσίνης C από τους Σμιθ (Smith) και συνεργάτες.[56] Η λακτόνη 1 μετατράπηκε στο αναγκαίο διένιο, με δύο διαδοχικές σιλυλιώσεις με TMSCl και η αντίδραση με τη βρομοκινόνη όπως φαίνεται παρακάτω έδωσε το τελικό προϊόν με αρωματικοποίηση και καλή γενική απόδοση. Το διένιο σε αυτήν την περίπτωση είναι αξιοσημείωτο ως ένα σπάνιο παράδειγμα ενός κυκλικού παραγώγου του διενίου Ντανισέφσκι.

Οι Rawal και Kozmin, στη σύνθεση της ταμπερσονίνης (tabersonine) το 1998,[57] χρησιμοποίησαν μια αντίδραση Ντιλς-Άλντερ για να πετύχουν τη σχετική στερεοχημεία cis του αλκαλοειδούς πυρήνα. Η μετατροπή της cis-αλδεΰδης στο αντίστοιχο της αλκένιο από την ολεφίνωση Βίτιχ (Wittig) και η ακόλουθη μετάθεση κλεισίματος δακτυλίου (ring-closing metathesis) με έναν καταλύτη Σροκ (Schrock) έδωσαν τον δεύτερο δακτύλιο του αλκαλοειδή πυρήνα. Το διένιο σε αυτήν την περίπτωση είναι αξιοσημείωτο ως παράδειγμα ενός 1-αμινο-3-σιλοξυβουταδιενίου (1-amino-3-siloxybutadiene), γνωστού και ως διενίου Ράουαλ (Rawal).

Το 1988, οι Οκαμούρα και Γκίμπς (Okamura - Gibbs) ανέφεραν μια εναντιοεκλεκτική σύνθεση του (+)-sterpurene[58] που χαρακτηρίζει μια σημαντική ενδομοριακή αντίδραση Ντιλς-Άλντερ ενός αλλενίου. Η [2,3]-σιγματροπική αναδιάταξη (2,3-sigmatropic rearrangement) της θειοφαινυλικής ομάδας δίνει το σουλφοξείδιο όπως προχωράει παρακάτω εναντιοεξειδικευμένα λόγω της προκαθορισμένης στερεοχημείας της προπαργυλικής αλκοόλης. Με αυτόν τον τρόπο, το μοναδικό ισομερές του αλλενίου που σχηματίστηκε μπορεί να κατευθύνει την αντίδραση Ντιλς-Άλντερ να λάβει χώρα μόνο στην μια πλευρά του δημιουργούμενου ‘διενίου’.

Η σύνθεση Μίερς (Myers) της (-)-τετρακυκλίνης το 2005,[59] πέτυχε τον γραμμικό τετρακυκλικό πυρήνα του αντιβιοτικού με μια αντίδραση Ντιλς-Άλντερ. Η θερμικά εκκινούσα, συμπεριστροφική διάνοιξη του βενζοκυκλοβουτενίου δημιούργησε το ο-κινοδιμεθάνιο (o-quinodimethane), που αντέδρασε διαμοριακά για να δώσει τον σκελετό της τετρακυκλίνης· το εμφανιζόμενο διαστερεοϊσομερές κρυσταλλώθηκε στη συνέχεια από μεθανόλη μετά από καθαρισμό από χρωματογραφική στήλη. Οι δημιουργοί σημειώνουν ότι η ελεύθερη υδροξυλομάδα του διενοφίλου ήταν ζωτική για την επιτυχία της αντίδρασης, επειδή οι παραλλαγές που προστατεύουν το υδροξύλιο δεν αντιδρούν κάτω από αρκετές διαφορετικές συνθήκες αντίδρασης.

Ο Τακεμούρα κ.ά. (Takemura et al.) συνέθεσαν την κανθαραδρίνη το 1980 με αντίδραση Ντιλς-Άλντερ, χρησιμοποιώντας υψηλή πίεση στο δοχείο της αντίδρασης.[60]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑
- ↑ «Synthesis of the hydro aromatic sequence». Ann. 470: 62. 1929.
- ↑ Diels, O.; Alder, K. (1929). «Synthesis in the hydroaromatic series, IV. Announcement: The rearrangement of malein acid anhydride on arylated diene, triene and fulvene». Chemische Berichte 62 (8): 2081. doi:.
- ↑ Diels, O.; Alder, K. (1929). «Synthesen in der hydroaromatischen Reihe, V. Mitteilung: Über Δ4-Tetrahydro-o-phthalsäure». Chemische Berichte 62 (8): 2087. doi:.
- ↑ Kloetzel, M. C. (1948). «The Diels-Alder Reaction with Maleic AnhydridePresent address, University of Southern California, Los Angeles, California». Org. React. 4: 1–59. doi:. ISBN 0471264180.
- ↑ Holmes, H. L. (1948). «The Diels-Alder Reaction Ethylenic and Acetylenic Dienophiles». Org. React. 4: 60–173. doi:. ISBN 0471264180.
- ↑ 7,0 7,1 7,2 Nicolaou, K. C.; Snyder, Scott A.; Montagnon, Tamsyn; Vassilikogiannakis, Georgios (2002). «The Diels-Alder Reaction in Total Synthesis». Ang. Chem. Int. Ed. 41 (10): 1668. doi:.
- ↑ Zweifel, George S. and Nantz, Michael H. (2007) Modern Organic Synthesis: An Introduction; W.H. Freeman and Co.: New York, ISBN 0716772663.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 9,6 9,7 9,8 Carey, Part B., pp. 474–526
- ↑ 10,0 10,1 Dewar, MJ; Olivella, S; Stewart, JJ (1986). «Mechanism of the Diels-Alder reaction: Reactions of butadiene with ethylene and cyanoethylenes». J. Am. Chem. Soc. 108 (19): 5771–9. doi:. PMID 22175326.
- ↑ 11,0 11,1 11,2 Carey, Part A., pp. 836–50
- ↑ 12,0 12,1 12,2 Carey, Part A., p. 839
- ↑ Gajewski, Joseph J.; Peterson, Karen B.; Kagel, John R. (1987). «Transition-state structure variation in the Diels-Alder reaction from secondary deuterium kinetic isotope effects: The reaction of a nearly symmetrical diene and dienophile is nearly synchronous». J. Am. Chem. Soc. 109 (18): 5545. doi:.
- ↑ Houk, KN; Lin, YT; Brown, FK (1986). «Evidence for the concerted mechanism of the Diels-Alder reaction of butadiene with ethylene». J. Am. Chem. Soc. 108 (3): 554–6. doi:. PMID 22175504.
- ↑ Goldstein, E.; Beno, Brett; Houk, K. N. (1996). «Density Functional Theory Prediction of the Relative Energies and Isotope Effects for the Concerted and Stepwise Mechanisms of the Diels−Alder Reaction of Butadiene and Ethylene». J. Am. Chem. Soc. 118 (25): 6036. doi:.
- ↑ 16,0 16,1 Rideout, Darryl C.; Breslow, Ronald (1980). «Hydrophobic acceleration of Diels-Alder reactions». J. Am. Chem. Soc. 102 (26): 7816. doi:.
- ↑ Breslow, Ronald.; Guo, Tao. (1988). «Diels-Alder reactions in nonaqueous polar solvents. Kinetic effects of chaotropic and antichaotropic agents and of .beta.-cyclodextrin». J. Am. Chem. Soc. 110 (17): 5613. doi:.
- ↑ Breslow, Ronald; Rizzo, Carmelo J. (1991). «Chaotropic salt effects in a hydrophobically accelerated Diels-Alder reaction». J. Am. Chem. Soc. 113 (11): 4340. doi:.
- ↑ Hake, R.; McLendon, G.; Corin, A.; Holzschu, D. (1992). «Redox-dependent molecular recognition in proteins: Site-directed mutagenesis suggests that cytochrome c oxidation state governs binding and recognition to cytochrome c peroxidase». J. Am. Chem. Soc. 114 (13): 5442. doi:.
- ↑ J. Am. Chem. Soc. 95: 4902. 1973. doi:.
- ↑ Chem. Ber. 124: 238. 1991.
- ↑ Bull. Soc. Chim. Fr.: 103. 1987.
- ↑ Houk, K. N.; Luskus, L. J. (1971). «Influence of steric interactions on endo stereoselectivity». J. Am. Chem. Soc. 93 (18): 4606. doi:.
- ↑ Kobuke, Yoshiaki; Sugimoto, Takuji; Furukawa, Junji; Fueno, Takayuki (1972). «Role of attractive interactions in endo-exo stereoselectivities of Diels-Alder reactions». J. Am. Chem. Soc. 94 (10): 3633. doi:.
- ↑ Williamson, Kenneth Lee.; Hsu, Yuan-Fang Li. (1970). «Stereochemistry of the Diels-Alder reaction. II. Lewis acid catalysis of syn-anti isomerism». J. Am. Chem. Soc. 92 (25): 7385. doi:.
- ↑ Craig, David; Shipman, J. J.; Fowler, Ray B. (1961). «The Rate of Reaction of Maleic Anhydride with 1,3-Dienes as Related to Diene Conformation». J. Am. Chem. Soc. 83 (13): 2885. doi:.
- ↑ Rec. Trav. Chim. Pays-Bas 58: 643. 1939.
- ↑ Carey, Part A, p. 149
- ↑ Danishefsky, S.; Kitahara, T. (1974). «Useful diene for the Diels-Alder reaction». J. Am. Chem. Soc. 96 (25): 7807. doi:.
- ↑ Savard, Jacques; Brassard, Paul (1979). «Regiospecific syntheses of quinones using vinylketene acetals derived from unsaturated esters». Tetrahedron Let 20 (51): 4911. doi:.
- ↑ Kozmin, Sergey A.; Rawal, Viresh H. (1997). «Preparation and Diels−Alder Reactivity of 1-Amino-3-siloxy-1,3-butadienes». J. Org. Chem 62 (16): 5252. doi:.
- ↑ Klundt, Irwin L. (1970). «Benzocyclobutene and its derivatives». Chem. Rev. 70 (4): 471. doi:.
- ↑ Ito, Yoshihiko; Nakatsuka, Masashi; Saegusa, Takeo (1982). «Syntheses of polycyclic ring systems based on the new generation of o-quinodimethanes». J. Am. Chem. Soc. 104 (26): 7609. doi:.
- ↑ Sano, Hiroshi.; Ohtsuka, Hideki.; Migita, Toshihiko. (1988). «A convenient method for the generation of o-quinodimethanes by proton induced 1,4-elimination of o-(1-hydroxyalkyl)benzyltributylstannanes». J. Am. Chem. Soc. 110 (6): 2014. doi:.
- ↑ Soon, Hyung Woo (1993). «A novel method for the generation of o – quinodimethane by selenium – induced fragmentation of o – vinyl benzyltributylstannane». Tetrahedron Let 34 (47): 7587. doi:. https://archive.org/details/sim_tetrahedron-letters_1993-11-19_34_47/page/n94.
- ↑ Hyung Woo, Soon (1994). «Lewis acid-promoted generation of α-oxy-o-quinodimethanes and cycloaddition reactions». Tetrahedron Let 35 (23): 3975. doi:.
- ↑ Rubottom, G. M.; Way, J. E. (1984). «An Improved Method for the Preparation of o-Quinodimethanes». Syn. Comm. 14 (6): 507. doi:.
- ↑ Synthesis: 289. 1977.
- ↑ «Intramolecular Diels–Alder Reactions». Comprehensive Organic Synthesis. 5. 1991, σελ. 513–550. doi:. ISBN 978-0-08-052349-1.
- ↑ 40,0 40,1 Grieco, Paul A. and Larsen, Scott D. Iminium Ion-Based Diels–Alder Reactions: N-Benzyl-2-Azanorborene. Org. Syntheses 8 (1993) 31; 68 (1990) 206
- ↑ Evans, David A.; Chapman, K. T.; Bisaha, J. (1988). «Asymmetric Diels-Alder cycloaddition reactions with chiral α,β-unsaturated N-acyloxazolidinones». J. Am. Chem. Soc. 110 (4): 1238. doi:.
- ↑ Corey, E. J.; Loh, Teck Peng (1991). «First application of attractive intramolecular interactions to the design of chiral catalysts for highly enantioselective Diels-Alder reactions». J. Am. Chem. Soc. 113 (23): 8966. doi:.
- ↑ Corey, EJ; Shibata, T; Lee, TW (2002). «Asymmetric Diels-Alder reactions catalyzed by a triflic acid activated chiral oxazaborolidine». J. Am. Chem. Soc. 124 (15): 3808–9. doi:. PMID 11942799.
- ↑ Ryu, DH; Corey, EJ (2003). «Triflimide activation of a chiral oxazaborolidine leads to a more general catalytic system for enantioselective Diels-Alder addition». J. Am. Chem. Soc. 125 (21): 6388–90. doi:. PMID 12785777.
- ↑ Johnson, JS; Evans, DA (2000). «Chiral bis(oxazoline) copper(II) complexes: Versatile catalysts for enantioselective cycloaddition, Aldol, Michael, and carbonyl ene reactions». Acc. Chem. Res. 33 (6): 325–35. doi:. PMID 10891050.
- ↑ Ahrendt, Kateri A.; Borths, Christopher J.; MacMillan, David W. C. (2000). «New Strategies for Organic Catalysis: The First Highly Enantioselective Organocatalytic Diels−Alder Reaction». J. Am. Chem. Soc. 122 (17): 4243. doi:.
- ↑ Woodward, R. B.; Sondheimer, Franz; Taub, David; Heusler, Karl; McLamore, W. M. (1952). «The Total Synthesis of Steroids1». J. Am. Chem. Soc. 74 (17): 4223. doi:.
- ↑ Corey, EJ; Weinshenker, NM; Schaaf, TK; Huber, W (1969). «Stereo-controlled synthesis of prostaglandins F-2a and E-2 (dl)». J. Am. Chem. Soc. 91 (20): 5675–7. doi:. PMID 5808505.
- ↑ Nicolaou, K.C. and Sorensen, Erik J. (1996) Classics in Total Synthesis: Targets, Strategies, Methods, Wiley VCH: New York
- ↑ De Lucchi, Ottorino; Pasquato, Lucia (1988). «The role of sulfur functionalities in activating and directing olefins in cycloaddition reactions». Tetrahedron 44 (22): 6755. doi:. https://archive.org/details/sim_tetrahedron_1988_44_22/page/6755.
- ↑ Danishefsky, Samuel; Hirama, Masahiro; Fritsch, Nancy; Clardy, Jon (1979). «Synthesis of disodium prephenate and disodium epiprephenate. Stereochemistry of prephenic acid and an observation on the base-catalyzed rearrangement of prephenic acid to p-hydroxyphenyllactic acid». J. Am. Chem. Soc. 101 (23): 7013. doi:.
- ↑ Wender, P. A.; Schaus, J. M.; White, A. W. (1980). «General methodology for cis-hydroisoquinoline synthesis: Synthesis of reserpine». J. Am. Chem. Soc. 102 (19): 6157. doi:.
- ↑ Martin, Stephen F.; Rueger, Heinrich; Williamson, Sidney A.; Grzejszczak, Slawek (1987). «General strategies for the synthesis of indole alkaloids. Total synthesis of (±)-reserpine and (±)-α-yohimbine». J. Am. Chem. Soc. 109 (20): 6124. doi:.
- ↑ Nicolaou, KC; Yang, Z; Liu, JJ; Ueno, H; Nantermet, PG; Guy, RK; Claiborne, CF; Renaud, J και άλλοι. (1994). «Total synthesis of taxol». Nature 367 (6464): 630–4. doi:. PMID 7906395.
- ↑ Synthesis: 1171. 1991.
- ↑ Smith, Amos B.; Sestelo, Jose Perez; Dormer, Peter G. (1995). «Total Synthesis of (-)-Furaquinocin C». J. Am. Chem. Soc. 117 (43): 10755. doi:.
- ↑ Kozmin, Sergey A.; Rawal, Viresh H. (1998). «A General Strategy toAspidospermaAlkaloids: Efficient, Stereocontrolled Synthesis of Tabersonine». J. Am. Chem. Soc. 120 (51): 13523. doi:.
- ↑ Gibbs, Richard A.; Okamura, William H. (1988). «A short enantioselective synthesis of (+)-sterpurene: Complete intramolecular transfer of central to axial to central chiral elements». J. Am. Chem. Soc. 110 (12): 4062. doi:.
- ↑ Charest, MG; Siegel, DR; Myers, AG (2005). «Synthesis of (-)-tetracycline». J. Am. Chem. Soc. 127 (23): 8292–3. doi:. PMID 15941256.
- ↑ Dauben, W. G.; Kessel, C. R.; Takemura (1980). J. Am. Chem. Soc 102: 6893–6894. doi:.
Βιβλιογραφία
[Επεξεργασία | επεξεργασία κώδικα]- Carey, Francis A. and Sundberg, Richard J. (2007). Advanced Organic Chemistry: Part B: Reactions and Synthesis (5th έκδοση). New York: Springer. ISBN 0387448993 (part A), ISBN 0387683542 (part B)
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- Asymmetric Hetero-Diels–Alder Reactions
- Semi-empirical calculations of the Diels–Alder reaction.
- Endo Addition Rule
- Recent Advances in Asymmetric Diels-Alder Reactions
