Αντίδραση Γκρινιάρ
| Κλασική αντίδραση Γκρινιάρ | |
|---|---|
| Ονομάστηκε από | Βικτόρ Γκρινιάρ |
| Τύπος αντίδρασης | Αντίδραση σύζευξης |
| Αναγνωριστικά | |
| Πύλη οργανικής χημείας | Γκρινιάρ.shtm Αντίδραση Γκρινιάρ |
| ID οντολογίας RSC | RXNO:0000014 |

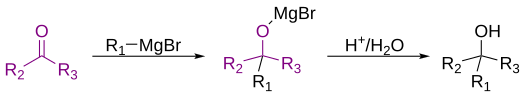
Η αντίδραση Γκρινιάρ (Grignard) είναι οργανομεταλλική χημική αντίδραση στην οποία, σύμφωνα με τον κλασικό ορισμό, το αντιδραστήριο Grignard R-Mg-X, όπου R= αλκύλιο, αλλύλιο, βινύλιο, ή αρύλιο και X = αλογονίδιο προστίθεται σε καρβονύλιο, είτε αλδεΰδη είτε κετόνη υπό άνυδρες συνθήκες.[1][2][3] Αυτή η αντίδραση είναι σημαντική για το σχηματισμό δεσμών άνθρακα-άνθρακα.[4][5]
Ιστορικό και ορισμοί
[Επεξεργασία | επεξεργασία κώδικα]Οι αντιδράσεις και τα αντιδραστήρια Γκρινιάρ ανακαλύφθηκαν από και ονομάστηκαν από τον Γάλλο χημικό Βικτόρ Γκρινιάρ, ο οποίος τα περιέγραψε το 1900.[6] Του απονεμήθηκε το Βραβείο Νόμπελ Χημείας για αυτό το έργο το 1912.[7] Η αντίδραση ενός οργανικού αλογονιδίου με μαγνήσιο «δεν» είναι αντίδραση Γκρινιάρ, αλλά παρέχει ένα αντιδραστήριο Γκρινιάρ.[8]

Κλασικά, η αντίδραση Γκρινιάρ αναφέρεται στην αντίδραση μεταξύ μιας ομάδας κετόνης ή αλδεΰδης με ένα αντιδραστήριο Γκρινιάρ για να σχηματιστεί μια πρωτοταγής ή τριτοταγής αλκοόλη.[1] Ωστόσο, ορισμένοι χημικοί κατανοούν τον ορισμό ότι σημαίνει όλες τις αντιδράσεις οποιωνδήποτε ηλεκτρονιόφιλων με αντιδραστήρια Γκρινιάρ.[9] Επομένως, υπάρχει κάποια διαφωνία σχετικά με τον σύγχρονο ορισμό της αντίδρασης Γκρινιάρ. Στο Merck Index, που δημοσιεύεται διαδικτυακά από τη Royal Society of Chemistry, αναγνωρίζεται ο κλασικός ορισμός, ακολουθούμενος από το "Μια πιο σύγχρονη ερμηνεία επεκτείνει το πεδίο της αντίδρασης για να συμπεριλάβει την προσθήκη αντιδραστηρίων Γκρινιάρ σε μια μεγάλη ποικιλία ηλεκτρονιόφιλων υποστρωμάτων."[9] Αυτή η ποικιλία ορισμών δείχνει ότι υπάρχει κάποια διαφωνία στην κοινότητα της χημείας σχετικά με τον ορισμό της αντίδρασης Γκρινιάρ. Παρακάτω παρουσιάζονται ορισμένες αντιδράσεις που περιλαμβάνουν αντιδραστήρια Γκρινιάρ, αλλά οι ίδιες δεν γίνονται κλασικά κατανοητές ως αντιδράσεις Γκρινιάρ.

Μηχανισμός αντίδρασης
[Επεξεργασία | επεξεργασία κώδικα]Επειδή ο άνθρακας είναι περισσότερο ηλεκτραρνητικός από το μαγνήσιο, ο άνθρακας που συνδέεται με το μαγνήσιο δρα ως πυρηνόφιλος και προσβάλλει το ηλεκτρονιόφιλο άτομο άνθρακα στον πολικό δεσμό μιας καρβονυλικής ομάδας. Η προσθήκη του αντιδραστηρίου Γκρινιάρ στην καρβονυλική ομάδα τυπικά προχωρά μέσω ενός εξαμελούς δακτυλίου σε μεταβατική κατάσταση, όπως φαίνεται παρακάτω.[10]

Με βάση την ανίχνευση παραπροϊόντων σύζευξης ριζών, έχει επίσης προταθεί ένας εναλλακτικός μηχανισμός μεταφοράς απλού ηλεκτρονίου (single electron transfer, SET) που περιλαμβάνει τον αρχικό σχηματισμό ενός ενδιάμεσου ριζικού κετυλίου.[11] Μια πρόσφατη υπολογιστική μελέτη υποδηλώνει ότι ο λειτουργικός μηχανισμός (πολικός έναντι ριζικού) εξαρτάται από το υπόστρωμα, με το δυναμικό αναγωγής της καρβονυλικής ένωσης να χρησιμεύει ως βασική παράμετρος.[12]
Συνθήκες
[Επεξεργασία | επεξεργασία κώδικα]
Η αντίδραση Γκρινιάρ διεξάγεται υπό άνυδρες συνθήκες.[3] Διαφορετικά, η αντίδραση θα αποτύχει, επειδή το αντιδραστήριο Grignard θα λειτουργήσει ως βάση και όχι ως πυρηνόφιλο και θα συλλέξει ένα ασταθές πρωτόνιο αντί να προσβάλλει στην ηλεκτρονιόφιλη θέση. Αυτό θα οδηγήσει σε μη σχηματισμό του επιθυμητού προϊόντος καθώς η ομάδα R του αντιδραστηρίου Γκρινιάρ θα πρωτονιωθεί ενώ το τμήμα MgX θα σταθεροποιήσει το αποπρωτονιωμένο είδος. Για να αποφευχθεί αυτό, οι αντιδράσεις Γκρινιάρ ολοκληρώνονται σε αδρανή ατμόσφαιρα για να αφαιρεθεί όλο το νερό από τη φιάλη αντίδρασης και να διασφαλιστεί ότι σχηματίζεται το επιθυμητό προϊόν.[13] Επιπλέον, εάν υπάρχουν όξινα πρωτόνια στο αρχικό υλικό, όπως φαίνεται στο σχήμα στα δεξιά, μπορεί κανείς να το ξεπεράσει προστατεύοντας την όξινη θέση του αντιδρώντος μετατρέποντάς το σε αιθέρα ή σιλυλαιθέρα (silyl ether) για την απομάκρυνση του ασταθούς πρωτονίου από το διάλυμα πριν από την αντίδραση Γκρινιάρ.
Παραλλαγές
[Επεξεργασία | επεξεργασία κώδικα]Άλλες παραλλαγές του αντιδραστηρίου Γκρινιάρ έχουν ανακαλυφθεί για τη βελτίωση της χημειοεκλεκτικότητας της αντίδρασης Γκρινιάρ, οι οποίες περιλαμβάνουν, αλλά δεν περιορίζονται σε αυτές: Turbo-Grignards, αντιδραστήρια οργανοδημητρίου και οργανικά αντιδραστήρια ιόντων με χαλκό (organocuprate)(Gilman).
Turbo-Grignards
[Επεξεργασία | επεξεργασία κώδικα]Τα Turbo-Grignard είναι αντιδραστήρια Γκρινιάρ τροποποιημένα με χλωριούχο λίθιο. Σε σύγκριση με τα συμβατικά αντιδραστήρια Γκρινιάρ, τα Turbo-Grignard είναι περισσότερο χημειοεκλεκτικά. Οι εστέρας, αμίδια και νιτρίλια δεν αντιδρούν με το αντιδραστήριο Turbo-Grignard.[14]

Αντιδραστήρια Grignard τροποποιημένα με ετερομέταλλο
[Επεξεργασία | επεξεργασία κώδικα]
Η συμπεριφορά των αντιδραστηρίων Γκρινιάρ μπορεί να τροποποιηθεί χρήσιμα παρουσία άλλων μετάλλων.Τα άλατα χαλκού(Ι) δίνουν το αντιδραστήριο Gilman που επιδρά κατά προτίμηση στην 1,4 προσθήκη.[15]Το τριχλωριούχο δημήτριο επιτρέπει επιλεκτικές προσθήκες 1,2 στα ίδια υποστρώματα. Τα αλογονίδια νικελίου και παλλαδίου καταλύουν αντιδράσεις διασταυρούμενης σύζευξης.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th έκδοση), New York: Wiley-Interscience, ISBN 978-0-471-72091-1, https://books.google.com/books?id=JDR-nZpojeEC&printsec=frontcover
- ↑ Chapter 19: Carboxylic Acids. Organic Chemistry 4e Carey. mhhe.com
- ↑ 3,0 3,1 3,2 Ouellette, Robert J.; Rawn, J. David (2014-01-01), Ouellette, Robert J.; Rawn, J. David, επιμ., 15 - Alcohols: Reactions and Synthesis, Boston: Elsevier, σελ. 491–534, doi:, ISBN 978-0-12-800780-8, https://www.sciencedirect.com/science/article/pii/B9780128007808000152, ανακτήθηκε στις 2023-11-06
- ↑ Shirley, D. A. (1954). «The Synthesis of Ketones from Acid Halides and Organometallic Compounds of Magnesium, Zinc, and Cadmium». Org. React. 8: 28–58.
- ↑ Huryn, D. M. (1991). «Carbanions of Alkali and Alkaline Earth Cations: (ii) Selectivity of Carbonyl Addition Reactions». Στο: Trost, B. M.· Fleming, I. Comprehensive Organic Synthesis, Volume 1: Additions to C—X π-Bonds, Part 1. Elsevier Science. σελίδες 49–75. doi:10.1016/B978-0-08-052349-1.00002-0. ISBN 978-0-08-052349-1.
- ↑ texte, Académie des sciences (France) Auteur du (1 Ιανουαρίου 1900). «Comptes rendus hebdomadaires des séances de l'Académie des sciences / publiés... par MM. les secrétaires perpétuels». Gallica (στα Αγγλικά). Ανακτήθηκε στις 23 Απριλίου 2023.
- ↑ Grignard, V. (1900). «Sur quelques nouvelles combinaisons organométaliques du magnésium et leur application à des synthèses d'alcools et d'hydrocabures». Compt. Rend. 130: 1322–25. http://gallica.bnf.fr/ark:/12148/bpt6k3086n/f1322.table.
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). (ISBN 0-9678550-9-8). .
- ↑ 9,0 9,1 «Grignard Reaction | The Merck Index Online». www.rsc.org. Ανακτήθηκε στις 23 Απριλίου 2023.
- ↑ Maruyama, K.; Katagiri, T. (1989). «Mechanism of the Grignard reaction». J. Phys. Org. Chem. 2 (3): 205–213. doi:.
- ↑ Ashby, E. C.; Goel, A. B. (August 1981). «Direct evidence supporting a single electron transfer pathway in the reduction of ketones by primary, secondary, and tertiary Grignard reagents» (στα αγγλικά). Journal of the American Chemical Society 103 (16): 4983–4985. doi:. ISSN 0002-7863. https://pubs.acs.org/doi/abs/10.1021/ja00406a070.
- ↑ Peltzer, Raphael Mathias; Gauss, Jürgen; Eisenstein, Odile; Cascella, Michele (2020-02-12). «The Grignard Reaction – Unraveling a Chemical Puzzle» (στα αγγλικά). Journal of the American Chemical Society 142 (6): 2984–2994. doi:. ISSN 0002-7863. PMID 31951398. https://pubs.acs.org/doi/abs/10.1021/jacs.9b11829.
- ↑ Carey, Francis A. «Grignard reagent». Britannica.
- ↑ Hermann, Andreas; Seymen, Rana; Brieger, Lukas; Kleinheider, Johannes; Grabe, Bastian; Hiller, Wolf; Strohmann, Carsten (2023). «Comprehensive Study of the Enhanced Reactivity of Turbo-Grignard Reagents*». Angewandte Chemie International Edition 62 (25). doi:. PMID 36971042.
- ↑ Woodward, Simon (2000-01-01). «Decoding the 'black box' reactivity that is organocuprate conjugate addition chemistry» (στα αγγλικά). Chemical Society Reviews 29 (6): 393–401. doi:. ISSN 1460-4744. https://pubs.rsc.org/en/content/articlelanding/2000/cs/b002690p.
