Αυτοϊοντισμός νερού

Αυτοïοντισμός του νερού είναι η αντίδραση του νερού ή κάποιου υδατικού διαλύματος, κατά την οποία το μόριο του νερού Η2Ο χάνει ένα πρωτόνιο (ένα ιόν H+) αφήνοντας πίσω του ένα ιόν ΟΗ− και σχηματίζοντας ένα κατιόν υδρονίου H3O+ (πρωτονίωση).[1] Από την αντίδραση αυτή οφείλεται και η μικρή αγωγιμότητα (0.055 µS∙cm−1) που εμφανίζεται στο νερό, αν και συνήθως θεωρείται μη ηλεκτρολύτης[1]
Ο αυτοϊοντισμός του νερού περιγράφεται από την αμφίδρομη αντίδραση:
Η2Ο + Η2Ο Η3Ο+ + ΟΗ-
Στην πρωτολυτική αυτή αντίδραση το ένα μόριο νερού δρα ως οξύ (δότης πρωτονίου) και το άλλο δρα ως βάση (δέκτης πρωτονίου) σύμφωνα με τη θεωρία των Bronsted-Lowry. Συνήθως στους χημικούς τύπους εμφανίζεται το σύμβολο H+, δηλαδή εμφανίζεται στην αντίδραση ένα πρωτόνιο, ενώ στην πραγματικότητα υπάρχει συνενωμένο σε ένα μόριο νερού ως Η3Ο+. Η περιεκτικότητα ενός διαλύματος σε Η3Ο+ και ΟΗ- καθορίζει το pH του.
Γενικότερα ο αυτοïοντισμός, είναι η αντίδραση στην οποία δύο όμοια μόρια αντιδρούν παρέχοντας ιόντα.
Υπάρχουν και άλλες χημικές ενώσεις που αυτοϊοντίζονται όπως π.χ. η αμμωνία ΝΗ3 (ΝΗ3 + ΝΗ3 ΝΗ4+ + ΝΗ2-), το θειικό οξύ Η2SO4 (Η2SO4 + H2SO4 H3SO4+ + HSO4-) κ.ά.
Σταθερά ισορροπίας
[Επεξεργασία | επεξεργασία κώδικα]Η σταθερά ισορροπίας του αυτοϊοντισμού του νερού είναι
από όπου προκύπτει η σταθερά γινομένου ιόντων του νερού ή σταθερά ιοντισμού του νερού Κw .
Η οποία για 25 °C είναι ίση με .[1]
Από αυτήν ορίζουμε και την
Εξάρτηση από θερμοκρασία, πίεση, ιοντική ισχύ
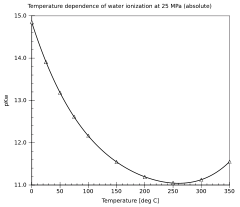
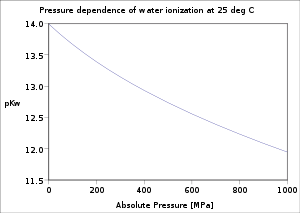
[Επεξεργασία | επεξεργασία κώδικα]Η εξάρτηση του ιονισμού του νερού από τη θερμοκρασία και την πίεση έχει ερευνηθεί εκτενώς.[2] Η τιμή της pKw μειώνεται όσο η θερμοκρασία αυξάνεται, από το σημείο ζέσεως του πάγου μέχρι τουλάχιστον τους 250 °C περίπου, μετά αυξάνεται μέχρι το κρίσιμο σημείο του νερού στους 374 °C. Αντίστοιχα μειώνεται όσο αυξάνεται η πίεση.
| Θερμοκρασία | Πίεση[4] | pKw |
|---|---|---|
| 0 °C | 0.10 MPa | 14.95 |
| 25 °C | 0.10 MPa | 13.99 |
| 50 °C | 0.10 MPa | 13.26 |
| 75 °C | 0.10 MPa | 12.70 |
| 100 °C | 0.10 MPa | 12.25 |
| 150 °C | 0.47 MPa | 11.64 |
| 200 °C | 1.5 MPa | 11.31 |
| 250 °C | 4.0 MPa | 11.20 |
| 300 °C | 8.7 MPa | 11.34 |
| 350 °C | 17 MPa | 11.92 |
Σε υλεκτρολυτικά διαλύματα, η τιμή της pKw εξαρτάται από την ιοντική ισχύ του ηλεκτρολύτη. Οι τιμές για διαλύματα NaCl είναι τυπικές για αναλογία 1:1 με ηλεκτρολύτες. Για αναλογία 1:2 η pKw μειώνεται όσο αυξάνεται η ιοντική ισχύς.[5]
Η τιμή της Kw συνήθως μας ενδιαφέρει στην υγρή φάση. Ενδεικτικές τιμές για υπέρθερμο ατμό και υπερκρίσιμο νερό εμφανίζονται στον ακόλουθο πίνακα:
Ενδεικτικές τιμές pKw για νερό στην υγρή φάση, ως υπέρθερμος ατμός, και ως υπερκρίσιμο ρευστό.[6] T/°C 350 400 450 500 600 800 0.1 MPa 11.920 (l)a 47.961b 47.873b 47.638 b 46.384 b 40.785 b 25 MPa 11.551 (l)c 16.566 18.135 18.758 19.425 20.113 100 MPa 10.600 (l)c 10.744 11.005 11.381 12.296 13.544 1000 MPa 8.311 (l)c 8.178 8.084 8.019 7.952 7.957
Οι τιμές αναφέρονται σε υπερκρίσιμο ρευστό εκτός από αυτές που σημειώνονται με: a για την πίεση κορεσμού στους 350°C. b υπέρθερμος ατμός. c υποψυχθέν υγρό.
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 1,2 D. Ebbing, S. Gammon. Γενική Χημεία. ΤΡΑΥΛΟΣ. σελ. 665. ISBN 960-7990-66-8.
- ↑ International Association for the Properties of Water and Steam (IAPWS)
- ↑ Bandura, Andrei V.; Lvov, Serguei N. (2006). «The Ionization Constant of Water over Wide Ranges of Temperature and Density». Journal of Physical and Chemical Reference Data 35 (1): 15–30. doi:. Αρχειοθετήθηκε από το πρωτότυπο στις 2013-05-12. https://web.archive.org/web/20130512174613/http://www.nist.gov/data/PDFfiles/jpcrd696.pdf. Ανακτήθηκε στις 2014-12-18.
- ↑ 0.1 MPa for T < 100°C. Saturation pressure for T ≥ 100°C.
- ↑ Harned, H.S.· Owen,, B.B. (1958). The Physical Chemistry of Electrolytic Solutions (£rd. έκδοση). New York: Reinhold Publishing Corp.,. σελίδες 634–649, 752–754.
- ↑ "Release on the Ionization Constant of H2O" Αρχειοθετήθηκε 2014-08-02 στο Wayback Machine. The International Association for the Properties of Water and Steam, Lucerne, Switzerland, August 2007.


![{\displaystyle K_{\rm {c}}={\frac {[{\rm {H_{3}O^{+}}}][{\rm {OH^{-}}}]}{[{\rm {H_{2}O}}]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/992d52146b1ca0101fbcb50b3f22719fb53a2d41)
![{\displaystyle K_{\rm {w}}=[{\rm {H_{3}O^{+}}}][{\rm {OH^{-}}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86dca39006c4f875cacc14395c7ff6e38a09d990)