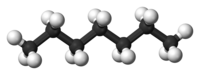
Επτάνιο
| Επτάνιο | |||
|---|---|---|---|
| |||
| Γενικά | |||
| Όνομα IUPAC | Επτάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C7H16 | ||
| Μοριακή μάζα | 100,21 amu | ||
| Σύντομος συντακτικός τύπος |
CΗ3(CH2)5CΗ3 | ||
| Συντομογραφίες | BuPr | ||
| Αριθμός CAS | 142-82-5 | ||
| SMILES | CCCCCCC | ||
| InChI | 1/C7H16/c1-3-5-7-6-4-2/h3-7H2,1-2H3 | ||
| Αριθμός RTECS | MI7700000 | ||
| PubChem CID | 8900 | ||
| ChemSpider ID | 8560 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 8 2-μεθυλοεξάνιο | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −90,61 °C | ||
| Σημείο βρασμού | 98,42 °C | ||
| Πυκνότητα | 684 kg/m3 | ||
| Ιξώδες | 0,386 cP (20 °C) | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Βαθμός οκτανίου | 0[1] | ||
| Βαθμός κετανίου | 52,5 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-4 °C | ||
| Σημείο αυτανάφλεξης | 285 °C | ||
| Επικινδυνότητα | |||
  
| |||
| Εξαιρετικά εύφλεκτο (F+), Επιβλαβές (Xn), Τοξικό για τους υδρόβιους οργανισμούς (N) | |||
| Φράσεις κινδύνου | R12, R51/53, R65, R66, R67 | ||
| Φράσεις ασφαλείας | S2, S9, S16, S29, S33, S61, S62 | ||
| MSDS | Σύνδεσμος MSDS | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το επτάνιο[2] είναι ένα αλκάνιο, δηλαδή άκυκλος κορεσμένος υδρογονάνθρακας, μοριακό τύπο C7H16 και ημισυντακτικό τύπο CH3(CH2)5CH3. Το επτάνιο έχει εξ' ορισμού βαθμό οκτανίου μηδέν (0).
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «επτάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «επτ-» δηλώνει την παρουσία επτά (7) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, δηλαδή ότι είναι υδρογονάνθρακας.
Δομή
[Επεξεργασία | επεξεργασία κώδικα]Το μόριό του αποτελείται από επτά (7) άτομα άνθρακα (δύο (2) πρωτοταγή[3] και πέντε (5) δευτεροταγή[4]) και δεκαέξι (16) άτομα υδρογόνου.
| Δεσμοί[5] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-C | σ | 2sp3-2sp3 | 154 pm | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C#1,#7 | -0,09 | |||
| C#2-#6 | -0,06 | |||
| H | +0,03 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Απομόνωση από φυσικές και βιομηχανικές πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Απομονώνεται από το πετρέλαιο.
- Απομονώνεται από μίγματα που προκύπτουν από πυρόλυση βαρύτερων προϊόντων διύλισης πετρελαίου ή πολυμερών υδρογονανθράκων.
Παρασκευή με αντιδράσεις σύνθεσης: Από πρώτες ύλες με μικρότερη ανθρακική αλυσίδα
[Επεξεργασία | επεξεργασία κώδικα]1. Από κατάλληλα ζεύγη αλκυλαλογονιδίου - αλκυλολιθίου:
- 1. Ζεύγος προπυλαλογονιδίου - βουτυλολιθίου ή προπυλολιθίου - βουτυλαλογονιδίου:
ή
- 2. Ζεύγος αιθυλαλογονιδίου - πεντυλολιθίου ή αιθυλολιθίου - πεντυλαλογονιδίου:
ή
- 3. Ζεύγος μεθυλαλογονιδίου - εξυλολιθίου ή μεθυλολιθίου - εξυλαλογονιδίου:
ή
2. Οι αντίστοιχες αντιδράσεις Wurtz είναι γενικά ασύμφορες γιατί παράγουν μίγματα με παραπροϊόντα. Π.χ.:[6]:
- Τα προϊόντα αυτά διαχωρίζονται σχετικά εύκολα: Το βαρύτερο, το δωδεκάνιο είναι υγρό (σ.ζ.: 216,2 °C
°C) στις ΣΣ[7] Το ζητούμενο (εδώ) επττάνιο είναι επίσης υγρό, αλλά πολύ πιο πτητικό (98,42°C) και το αιθάνιο είναι αέριο (σ.ζ.: -88,6 °C).
Παρασκευή με αντιδράσεις χωρίς αλλαγή ανθρακικής αλυσίδας
[Επεξεργασία | επεξεργασία κώδικα]1. Αναγωγή κατάλληλων αλκυλαλογονιδίων:
ή
ή
ή
- 2. Με αναγωγή από LiAlH4 ή NaBH4[9]:
ή
ή
ή
- 3 Με αναγωγή αντίστοιχων αλκυλιωδιδίων από HI:
ή
ή
ή
- 4 Με αναγωγή από μέταλλα και στη συνέχεια υδρόλυση των παραγόμενων οργανομεταλλικών ενώσεων:
- 1. Με χρήση Li:
[10]
ή
ή
ή
[12]
ή
ή
ή
2. Με καταλυτική υδρογόνωση κατάλληλων ακόρεστων αλειφατικών υδρογονανθράκων[13][14]:
- 1. Επτενίων:
ή
ή
- 2. Επταδιενίων:
ή
ή
ή
ή
ή
ή
ή
ή
- 3. Επτινίων:
ή
ή
- 4. Επτατριενίων:
ή
ή
ή
ή
ή
ή
ή
ή
ή
- 5. Επτενίνιων:
ή
ή
ή
ή
ή
ή
ή
ή
ή
- 6.Επτατετραένιων:
ή
ή
ή
ή
ή
ή
ή
- 7.Επταδιενίνιων:
ή
ή
ή
ή
ή
ή
ή
ή
ή
- 8. Επταδιινίων:
ή
ή
ή
ή
ή
- 9. Επταπενταένιων:
ή
ή
- 10. Επτατριενίνιων:
ή
ή
ή
ή
- 11. Επταενδιίνιων:
ή
ή
ή
- 12. Επτατριίνιων:
ή
- 13. Επταεξαένιων:
4. Με αναγωγή επτανάλης- Αντίδραση Wolf-Kishner[15]:
5. Με αναγωγή επτανόνης-2 ή επτανόνης-3 ή επτανόνης-4 - Αντίδραση Clemmensen[16]:
ή
ή
Παρασκευή με αντιδράσεις αποσύνθεσης με μείωση του μήκους της ανθρακικής αλυσίδας
[Επεξεργασία | επεξεργασία κώδικα]- Με τη θέρμανση αΛκαλικού διαλύματος οκτανικού οξέος (CH3CH2CH2CH2CH2CH2CH2COOH) ή 2-μεθυλοεπτανικού οξέος [CH3CH2CH2CH2CH2CH(CH3)COOH] ή 2-αιθυλοεξανικού οξέος [CH3CH2CH2CH2CH(CH2CH3)COOH] ή 2-προπυλοπεντανικού οξέος [CH3CH2CH2CH(CH2CH2CH3)COOH]
[17]:
ή
ή
ή
Φυσικές ιδιότητες και ισομερή
[Επεξεργασία | επεξεργασία κώδικα]Το επτάνιο έχει τα ακόλουθα οκτώ (8) [δέκα (10) αν μετρηθούν και τα εναντιομερή] ισομερή:
- CH3(CH2)3CH(CH3)2: 2-μεθυλεξάνιο ή ισοεπτάνιο.
- CH3(CH2)2*CH(CH3)CH2CH3: R,S-3-μεθυλεξάνιο.
- (CH3)3C(CH2)2CH3: 2,2-διμεθυλοπεντάνιο ή νεοεπτάνιο.
- (CH3)2CΗ*CH(CH3)CH2CH3: R,S-2,3-διμεθυλοπεντάνιο.
- (CH3)2CΗCH2CΗ(CH3)2: 2,4-διμεθυλοπεντάνιο.
- (CH3CH2)2C(CH3)2: 3,3-διμεθυλοπεντάνιο.
- (CH3CH2)3CH: αιθυλοπεντάνιο.
- (CH3)3CCH(CH3)2: τριμεθυλοβουτάνιο ή τριπτάνιο.
Τα ισομερή αυτά παρόλο που έχουν ίδιο χημικό τύπο και μοριακό βάρος, έχουν διαφορετικές δομές και διαφορετικές ιδιότητες.
| Συντακτικός τύπος Δομή |
Όνομα IUPAC (ελληνική μορφή) Όνομα |
Μοριακό Βάρος |
Σημείο ζέσεως (°C, 1 atm) |
| κ-επτάνιο επτάνιο |
100,21 | 98,42 | |
| 2-μεθυλεξάνιο ισοεπτάνιο |
100,21 | 90 | |
| 3-μεθυλεξάνιο | 100,21 | 90,7 | |
| 2,2-διμεθυλοπεντάνιο νεοεπτάνιο |
100,21 | 77,9 | |
| 2,3-διμεθυλοπεντάνιο | 100,21 | 89,4 | |
| 2,4-διμεθυλοπεντάνιο | 100,21 | 80,5 | |
| 3,3-διμεθυλοπεντάνιο | 100,21 | 85,7 | |
 |
αιθυλοπεντάνιο | 100,21 | 93,5 |
 |
τριμεθυλοβουτάνιο τριπτάνιο |
100,21 | 81,7 |
Χημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Οξείδωση
[Επεξεργασία | επεξεργασία κώδικα]1. Όπως όλα τα αλκάνια, το n-επτάνιο με περίσσεια οξυγόνου καίγεται προς διοξείδιο του άνθρακα και νερό[18]:
- Αν και η αντίδραση είναι μια έντονα εξώθερμη δεν συμβαίνει σε μέτριες θερμοκρασίες, γιατί για την έναρξή της πρέπει να υπερπηδηθεί πρώτα το εμπόδιο της διάσπασης των δεσμών C-C[19], των δεσμών C-H[20] και των δεσμών (Ο=Ο)[21] του O2:
2. Παραγωγή υδραερίου:
3. Καταλυτική οξείδωση προς επτανάνη-2, επτανάνη-3 και επτανάνη-4:
- Είναι τα κύρια προϊόντα της καταλυτικής οξείδωσης του πεντανίου, αλλά παράγεται και μια μικρή ποσότητα επτανάλης.
Αλογόνωση[22]
[Επεξεργασία | επεξεργασία κώδικα]
- Δραστικότητα των X2: F2 > Cl2 > Br2 > Ι2.
- όπου 0<a,b,c,d<1, a + b + c + d = 0, διαφέρουν ανάλογα με το αλογόνο:
- Τα F και Cl είναι πιο δραστικά και λιγότερο εκλεκτικά. Η αναλογία των προπυλαλογονιδίων τους εξαρτάται κυρίως πό τη στατιστική αναλογία των προς αντικατάσταση ατόμων H. Ειδικά γοα το χλώριο θα έχουμε:
- 1-χλωρεπτάνιο: 6·1 = 6.
- 2-χλωρεπτάνιο: 4·3,8 = 15,2.
- 3-χλωρεπτάνιο: 4·3,8 = 15,2.
- 4-χλωρεπτάνιο: 2·3,8 = 7,6.
- Τα F και Cl είναι πιο δραστικά και λιγότερο εκλεκτικά. Η αναλογία των προπυλαλογονιδίων τους εξαρτάται κυρίως πό τη στατιστική αναλογία των προς αντικατάσταση ατόμων H. Ειδικά γοα το χλώριο θα έχουμε:
- Δηλαδή το μίγμα που προκύπτει είναι: 13,7% 1-χλωρεπτάνιο, 34,5% 2-χλωρεπτάνιο, 34,5% 3-χλωρεπτάνιο και 17,3% 4-χλωρεπτάνιο.
- Τα Br και I είναι πιο εκλεκτικά και λιγότερο δραστικά. Η αναλογία των πεντυλαλογονιδίων μεταβάλλεται προς όφελος των δευτεροταγών (αυτών που το αλογόνο συνδέεται με δευτεροταγές άτομο C, δηλαδή ατόμου C ενωμένου με 2 άλλα άτομα C) πεντυλοαλογονίδιων. Ειδικα για το βρώμιο θα έχουμε:
- 1-βρωμεπτάνιο: 6·1 = 6.
- 2-βρωμεπτάνιο: 4·82 = 328.
- 3-βρωμεπτάνιο: 4·82 = 328.
- 4-βρωμεπτάνιο: 2·82 = 162.
- Δηλαδή το μίγμα που προκύπτει είναι: 0,7% 1-βρωμεπτάνιο, 39,8% 2-βρωμεπτάνιο, 39,8% 3-βρωμεπτάνιο και 32,7% 4-βρωμεπτάνιο.
- Ανάλυση του μηχανισμού της χλωρίωσης του CH3(CH2)5CH3:
- 1. Έναρξη: Παράγονται ελεύθερες ρίζες.
- Η απαιτούμενη ενέργεια προέρχεται από το υπεριώδες φως (UV) ή θερμότητα (Δ).
- 2. Διάδοση: Καταναλώνονται οι παλιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους οι ελεύθερες ρίζες, κατά τη στατιστικά σπάνια περίπτωση της συνάντησής τους.
- Είναι όμως πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή μονοαλογονοπαραγώγων.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες CH3(CH2)5CH3 και Χ2 θα παραχθεί μίγμα όλων των X-παραγώγων του CH3(CH2)5CH3
- Αν όμως χρησιμοποιηθει περίσσεια CH3(CH2)5CH3, τότε η απόδοση τωμ μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστική πιθανότητας συνάντισης CH3(CH2)5CH3 με X. σε σχέση με την πιθανότητα συνάντισης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
Παρεμβολή καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε;
- Παρεμβολή στους έξι (6) δεσμούς CH2-H: 6
- Παρεμβολή στους τέσσερεις (4) δεσμούς 2-CH-H: 4
- Παρεμβολή στους τέσσερεις (4) δεσμούς 3-CH-H: 4
- Παρεμβολή στους δύο (2) δεσμούς 4-CH-H: 2
Προκύπτει επομένως μίγμα οκτανίου ~37,5%, 2-μεθυλοεπτανίου ~25%, 3-μεθυλοεπτάνιου ~25% και 4-μεθυλοεπτάνιου 12,5%.
Καταλυτική ισομερείωση
[Επεξεργασία | επεξεργασία κώδικα]Το επτάνιο μπορεί να υποστεί καταλυτική ισομερείωση προς όλα τα ισομερή του:
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Εξ' ορισμού: Η κλίμακα του βαθμού οκτανίου ορίζεται με το επτάνιο ως 0 και το 2,2,4-τριμεθυλοπεντάνιο ως 100.
- ↑ Χρησιμοποιούνται συχνά τα προθέματα n- ή κ- για να επισημάνουν ότι αναφερόμαστε στο γραμμικό ισομερές.
- ↑ Άτομο C ενωμένο με ένα (1) άλλο άτομο C.
- ↑ Άτομο C ενωμένο με δύο (2) άλλα άτομα C.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2β, R = CH3, R' = CH3CH2CH2CH2
- ↑ Συνηθισμένες συνθήκες: P = 1 atm, Τ = 25 °C.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.1β., με R = CH3CH2CH2CH2CH2CH2CH2 ή CH3CH2CH2CH2CH2CHCH3 ή CH3CH2CH2CH2CHCH2CH3 ή CH3CH2CH2CHCH2CH2CH3
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, §6.2.1α., με R = CH3CH2CH2CH2CH2CH2CH2 ή CH3CH2CH2CH2CH2CHCH3 ή CH3CH2CH2CH2CHCH2CH3 ή CH3CH2CH2CHCH2CH2CH3
- ↑ όπου |Εt2Ο| : άνυδρος διαιθυλαιθέρας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.4α., με R = CH3CH2CH2CH2CH2CH2CH2 ή CH3CH2CH2CH2CH2CHCH3 ή CH3CH2CH2CH2CHCH2CH3 ή CH3CH2CH2CHCH2CH2CH3
- ↑ αντιδρασήριο Grignard
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6α, R = CH3CH2CH2CH2, R' = CH3 ή R = CH3CH2CH2CH2, R' = CH3CH2 ή R = R' = CH3CH2CH2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3α., με R = CH3CH2CH2CH2CH2CH2CH2 ή CH3CH2CH2CH2CH2CHCH3 ή CH3CH2CH2CH2CHCH2CH3 ή CH3CH2CH2CHCH2CH2CH3
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1, v = 7 και μετατροπή μονάδας ενέργειας σε kJ.
- ↑ ΔHC-C= +347 kJ/mol
- ↑ ΔHC-H = +415 kJ/mol
- ↑ ΔHO-O=+146 kJ/mol
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.1β., με R = CH3CH2CH2CH2CH2CH2CH2 ή CH3CH2CH2CH2CH2CHCH3 ή CH3CH2CH2CH2CHCH2CH3 ή CH3CH2CH2CHCH2CH2CH3
- ↑ καθοριστικό ταχύτητας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3, R = CH3CH2CH2CH2CH2CH2CH2 ή CH3CH2CH2CH2CH2CHCH3 ή CH3CH2CH2CH2CHCH2CH3 ή CH3CH2CH2CHCH2CH2CH3
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Χημικές ιδιότητες του επτανίου Αρχειοθετήθηκε 2013-04-11 στο Wayback Machine.
- Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.
- Τεχνικό δελτίο δεδομένων n-εξανίου από την Shell Chemicals[νεκρός σύνδεσμος]
- Παπαγεωργίου Β.Π., “Εφαρμοσμένη Οργανική Χημεία: Άκυκλες Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Μερικές από τις ενέργειες αντιδράσεων υπολογίστηκαν με χρήση κατάλληλου λογισμικού. Θα διασταυρωθούν και βιβλιογραφικά το συντομότερο για μεγαλύτερη ακρίβεια.






























































































































![{\displaystyle \mathrm {C_{7}H_{16}+7H_{2}O{\xrightarrow[{700-1100^{o}C}]{Ni}}7CO+15H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/119a5a66d5708abfee2e680b7581d54ae73a9239)
![{\displaystyle \mathrm {C_{7}H_{16}+O_{2}{\xrightarrow[{\triangle }]{Cu}}{\frac {2}{5}}CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}COCH_{3}+{\frac {2}{5}}CH_{3}CH_{2}CH_{2}CH_{2}COCH_{2}CH_{3}+{\frac {1}{5}}CH_{3}CH_{2}CH_{2}COCH_{2}CH_{2}CH_{3}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/bbc657a9547868f8e3d28bb61e90fc5ea654d7bb)
![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH_{2}CH_{2}CH_{2}CH_{3}+X_{2}{\xrightarrow[{\triangle }]{UV}}aCH_{3}CH_{2}CH_{2}CH_{2}CH_{2}CH_{2}CH_{2}X+bCH_{3}CH_{2}CH_{2}CH_{2}CH_{2}CHXCH_{3}+cCH_{3}CH_{2}CH_{2}CH_{2}CHXCH_{2}CH_{3}+dCH_{3}CH_{2}CH_{2}CHXCH_{2}CH_{2}CH_{3}+HX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1504f2f8362dbc31b97ea6127af3d4ee3f76bca0)
![{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}}2Cl^{\bullet }-239kJ} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/73fe9c8e7397e9e50d5b5a7ea91a25e26bed2f96)
















