Διφθοριούχο οξυγόνο
| Διφθοριούχο οξυγόνο | |||
|---|---|---|---|

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Διφθοριούχο οξυγόνο | ||
| Άλλες ονομασίες | Φθορυποφθοριώδες Φθοριούχο οξυγόνο Ανυδρίτης του υποφθοριώδους οξέος | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | OF2 | ||
| Μοριακή μάζα | 53,9962 ± 0,0003 amu | ||
| Αριθμός CAS | 7783-41-7 | ||
| SMILES | FOF | ||
| InChI | 1S/F2O/c1-3-2 | ||
| Αριθμός RTECS | RS2100000 | ||
| PubChem CID | 24547 | ||
| ChemSpider ID | 22953 | ||
| Δομή | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −223,8 °C | ||
| Σημείο βρασμού | −144,75 °C | ||
| Πυκνότητα | 1.900 kg/m³ (υγρό στους -224 °C) 1.719 kg/m³ (υγρό στους -183 °C) 1.521 kg/m³ (υγρό στους -145 °C) 2,42 kg/m³ (αέριο στους 0 °C) 1,88 kg/m³ (αέριο στους 20 °C) | ||
| Διαλυτότητα στο νερό |
Υδρολύεται[1] | ||
| Εμφάνιση | Άχρωμο αέριο. Πορτοκαλί υγρό, αν υγροποιηθεί. | ||
| Χημικές ιδιότητες | |||
| Αυτοδιάσπαση | 200 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Φράσεις κινδύνου | 26/27/28 | ||
| LD50 | 2,6 ppm (αρουραίοι, 1 ώρα) 1,5 ppm (ποντίκια, 1 ώρα) 26 ppm (σκύλοι, 1 ώρα) 16 ppm (πίθηκοι, 1 ώρα) | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
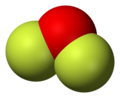
Το διφθοριούχο οξυγόνο[2] (αγγλικά: oxygen difluoride) είναι ανόργανη δυαδική χημική ένωση, με μοριακό τύπο OF2. Όπως προβλέφθηκε από τη θεωρία σθένους απώθησης ζευγών ηλεκτρονίων (valence shell electron pair repulsion, VSEPR Theory), το μόριο της ένωσης υιοθετεί μια γωνιακή («V») μοριακή γεωμετρία, όπως το νερό, αλλά έχει πολύ διαφορετικές ιδιότητες, όντας (μεταξύ άλλων) ισχυρό οξειδωτικό.
Φυσικές και δομικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Συμπυκνώνεται στους -144,8 °C σε ένα πορτοκαλί υγρό, που η μοριακή δομή του θυμίζει τη μοριακή δομή του νερού. Η γωνία FOF είναι 103° και το μήκος κάθε δεσμού της ένωσης είναι 140,5 pm.
| Δεσμοί[3][4] | |||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός | Ισχύς δεσμού |
|---|---|---|---|---|---|
| O-F | σ | 2sp³-2p | 140,5 pm | 7% O+ F– | 190 kJ/mol |
| Γωνίες | |||||
| FOF | 103° | ||||
| Στατιστικό ηλεκτρικό φορτίο[5] | |||||
| F | -0,07 | ||||
| O | +0,14 | ||||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το διφθοριούχο οξυγόνο αναφέρθηκε για πρώτη φορά το 1929, οπότε λήφθηκε με ηλεκτρόλυση μείγματος τηγμένου φθοριούχου καλίου (KF) και υδροφθορικού οξέος (HF), που περιείχαν μικρές ποσότητες νερού[6][7]. Η σύγχρονη παραγωγή εμπεριέχει αντίδραση (στοιχειακού) φθορίου με υδατικό διάλυμα υδροξειδίου του νατρίου (NaOH), συμπαράγοντας φθοριούχο νάτριο (NaF), ως παραπροϊόν:
Τέλος, το διφθοριούχο οξυγόνο μπορεί να παραχθεί αν οξειδωθούν υδρατμοί σε ατμόσφαιρα στοιχειακού φθορίου. Υπό αυτές τις συνθήκες συμπαράγεται υπεροξείδιο του υδρογόνου, ως παραπροϊόν. Η συγκεκριμένη αντίδραση πραγματοποιείται μέσω ενός μηχανισμού αντιδράσεων ελευθέρων ριζών:
Σημειώνεται ότι στις παραπάνω αντιδράσεις το Ο: παριστάνει ατομικό οξυγόνο, το οποίο δρα ως δίριζα. Η συνολική στοιχειομετρική εξίσωση της αντίδρασης προκύπτει με πρόσθεση κατά μέλη των παραπάνω μερικών (στοιχειομετρικών εξισώσεων):
Χημικές αντιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Το διφθοριούχο οξυγόνο έχει ισχυρές οξειδωτικές ιδιότητες, εφόσον σε αυτό το οξυγόνο έχει βαθμό οξείδωσης +2, που είναι ασυνήθιστο[8]. Πιο συγκεκριμένα, συνδυάζει την οξειδωτική ισχύ του ελεύθερου (στοιχειακού) φθορίου (F2) και το μηχανισμό οξείδωσης του όζοντος (O3), αλλά απαιτεί (σχετικά) υψηλότερη ενέργεια ενεργοποίησης (συγκεκριμένα απαιτεί 41 kcal/mol) σε σύγκριση με αυτά (φθόριο και όζον) τα οξειδωτικά.
Πάνω από τους 200° το διφθοριούχο οξυγόνο θερμοδιασπάται σε οξυγόνο και φθόριο, μέσω ενός μηχανισμού ελευθέρων ριζών.
Το διφθοριούχο οξυγόνο αντιδρά με πολλά μέταλλα παράγοντας τα αντίστοιχα οξείδια και φθορίδια.
Πιο συγκεκριμένα, το διφθοριούχο οξυγόνο αντιδρά σε θερμοκρασία δωματίου (20 °C) με το χαλκό, με το λευκόχρυσο, με το χρυσό και με τον άργυρο, σχηματίζοντας όμως μόνο ένα επιφανειακό προστατευτικό στρώμα φθοριδίων των αντιστοίχων μετάλλων. Αν όμως η θερμοκρασία αυξηθεί ως τους 250 °C συμβαίνει επιπρόσθετη οξείδωση των αντιστοίχων μετάλλων. Τα καταλληλότερα μέταλλα για κατεργασία μαζί με διφθοριούχο οξυγόνο είναι το αλουμίνιο και το μαγνήσιο. Ο ανοξείδωτος χάλυβας, το νικέλιο, το μέταλλο μόνελ[9], το κράμα μαγνησίου-χαλκού (92/8), ο ορείχαλκος και ο χαλκός, χάνουν, επίσης, πολύ λίγο βάρος των αντιστοίχων μετάλλων ή κραμάτων μετά από έκθεσή τους σε διφθοριούχο οξυγόνο για 1 - 1,5 εβδομάδες στους 100 °C. Το διφθοριούχο οξυγόνο αντιδρά έντονα με τον υδράργυρο, γεγονός που αποκλείει τη χρήση του μετάλλου αυτό από συσκευές που αναμένεται να εκτεθούν σε διφθοριούχο οξυγόνο.
Αντιδρά, όμως επίσης, και με αμέταλλα. Ο φωσφόρος αντιδρά με το διφθοριούχο οξυγόνο και συμπαράγει πενταφθοριούχο φωσφόρο (PF5), φωσφορυλοφθορίδιο (POF3) [και διοξυγόνο (O2)]:
Το θείο αντιδρά με το διφθοριούχο οξυγόνο και παράγει διοξείδιο του θείου (SO2) και τετραφθοριούχο θείο (SF4):
Επίσης, αν και ασυνήθιστο για ένα ευγενές αέριο, το ξένο αντιδρά με το διφθοριούχο οξυγόνο και παράγει τετραφθοριούχο ξένο (XeF4) ή και οξυτετραφθοριούχο ξένο (XeOF4)[10]:
Το διφθοριούχο οξυγόνο αντιδρά πολύ αργά με το νερό, σχηματίζοντας υδροφθορικό οξύ. Η αντίδραση επιταχύνεται με τη χρήση θερμού νερού, αλλά ακόμη περισσότερο σε αλκαλικό περιβάλλον:
Το διφθοριούχο οξυγόνο οξειδώνει το διοξείδιο του θείου σε τριοξείδιο του θείου (SO3):
Ωστόσο, με την παρουσία υπεριώδους ακτινοβολίας τα προϊόντα (με τα παραπάνω αντιδρώντα, δηλαδή OF2 και SO2) είναι θειονυλοφθορίδιο (SO2F2) και πυροθειονυλοφθορίδιο (S2O5F2):
Το διφθοριούχο οξυγόνο δεν επιδρά πάνω σε ξηρό γυαλί ή σε χαλαζία.
Σε υλικά που χρησιμοποιούνται για τη λίπανση βαλβίδων το διφθοριούχο οξυγόνο επιδρά, αλλά πολύ αργά.
Ασφάλεια
[Επεξεργασία | επεξεργασία κώδικα]Το διφθοριούχο οξυγόνο είναι επικίνδυνο χημικό, όπως συμβαίνει για κάθε ισχυρά οξειδωτικό αέριο.
Τοξικότητα
[Επεξεργασία | επεξεργασία κώδικα]Η τοξικότητα του διφθοριούχου οξυγόνου είναι συγκρίσιμη με την αντίστοιχη του φωσγένιου (που είναι χημικό όπλο). Συγκεκριμένα, το διφθοριούχο οξυγόνο είναι τοξικότερο από το στοιχειακό φθόριο, προκαλώντας εντονότερο ερεθισμό των σωματικών ιστών, τους οποίους διαπερνά βαθιά (βαθύτερα από το στοιχειακό φθόριο), διαλύοντάς τους. Κάνει την αναπνοή ακόμη πιο δύσκολη.
Επιστημονική φαντασία
[Επεξεργασία | επεξεργασία κώδικα]Στο μυθιστόρημα επιστημονικής φαντασίας Κάμελοτ 30K, του Ρόμπερτ Λ. Φόργουορντ (Robert L. Forward's science fiction novel Camelot 30K), το διφθοριούχο οξυγόνο (υποτίθεται) ότι χρησιμοποιήθηκε σε ένα βιοχημικό διάλυμα από μια φανταστική μορφή ζωής, που (υποτίθεται ότι) ζει στη Ζώνη του Κάιπερ του ηλιακού μας συστήματος.
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]- Υποφθοριώδες οξύ (HOF).
- Υδροφθοροϋπεροξείδιο (HO2F).
- Διφθοριούχο διοξυγόνο (O2F2).
- Φθοραμίνη (H2NF).
- Διφθοραμίνη (HNF2).
- Τριφθοριούχο άζωτο (NF3).
- Φθορυδραζίνη (HN2F).
- Τετραφθοριούχο θείο (SF4).
- Υποχλωριώδες οξύ (HClO).
- Μονοξείδιο του διχλωρίου (Cl2O).
- Μονοξείδιο του διβρωμίου (Br2O)
- Οξείδιο του διιωδίου (I2O)
- Διφθοριούχο θείο (SF2)
- Διχλωριούχο θείο (SCl2).
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ «Αρχειοθετημένο αντίγραφο». Αρχειοθετήθηκε από το πρωτότυπο στις 14 Ιουλίου 2014. Ανακτήθηκε στις 9 Ιανουαρίου 2014.
- ↑ Για εναλλακτικές ονομασίες και συμβολισμούς δείτε τον πίνακα πληροφοριών.
- ↑ Τα δεδομένα προέρχονται από τους πίνακες δεδομένων των στοιχείων άνθρακα, πυριτίου και υδρογόνου και τις πηγές«Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και «Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982»
- ↑ «chem.tamu.edu» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 28 Ιανουαρίου 2018.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ Lebeau, P.; Damiens, A. (1929). "Sur un nouveau mode de préparation du fluorure d'oxygène" [A new method of preparation of oxygen fluoride]. Comptes rendus hebdomadaires des séances de l’Académie des sciences (in French) 188: 1253–1255. Retrieved February 21, 2013.
- ↑ Lebeau, P.; Damiens, A. (1927). "Sur l'existence d'un composé oxygéné du fluor" [The existence of an oxygen compound of fluorine]. Comptes rendus hebdomadaires des séances de l’Académie des sciences (in French) 185: 652–654. Retrieved February 21, 2013.
- ↑ Ουσιαστικά, είναι η μόνη ουδέτερη ουσία που περιέχει οξυγόνο με αριθμό οξείδωσης +2, αφού (τουλάχιστον κατά Pauling) το φθόριο είναι το μόνο ηλεκτραρνητικότερο από το οξυγόνο χημικό στοιχείο.
- ↑ Σημείωση: Πρόκειται για ένα κράμα που αποτελείται κυρίως από νικέλιο και χαλκό.
- ↑ Εξαρτάται από τις συνθήκες αντίδρασης το ποια ακριβώς προϊόντα παράγονται.











![{\displaystyle \mathrm {OF_{2}+H_{2}O{\xrightarrow[{OH^{-}}]{\triangle }}2HF+O_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/47cb9c434419f8559b748226d8f0cf3a04220891)

