Εμπαγλιφλοζίνη
 | |
 | |
| Ονομασία IUPAC | |
|---|---|
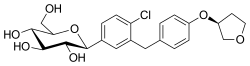
(2S,3R,4R,5S,6R)-2-[4-Chloro-3-[[4-[(3S)-oxolan-3-yl]oxyphenyl]methyl]phenyl]-6-(hydroxymethyl)oxane-3,4,5-triol | |
| Κλινικά δεδομένα | |
| Εμπορικές ονομασίες | Jardiance, Glyxambi, Synjardy, Trijardy [2] |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a614043 |
| Δεδομένα άδειας |
|
| Κατηγορία ασφαλείας κύησης | |
| Οδοί χορήγησης | Από το στόμα |
| Κυκλοφορία | |
| Κυκλοφορία |
|
| Φαρμακοκινητική | |
| Πρωτεϊνική σύνδεση | 86,2% [2] |
| Μεταβολισμός | Ελάχιστος- γλυκουρονιδίωση από UGT2B7, UGT1A3, UGT1A8, UGT1A9 [2] |
| Μεταβολίτες | 2-O-, 3-O- και 6-O-γλυκουρονίδιο |
| Έναρξη δράση | 1,5 ώρα (απο το στόμα) [2] |
| Βιολογικός χρόνος ημιζωής | 12,4 ώρες [2] |
| Διάρκεια δράσης | Μεγάλη [2] |
| Απέκκριση | Ούρα (54,4%) [2] Κόπρανα (41,2%) [2] |
| Κωδικοί | |
| Αριθμός CAS | 864070-44-0[2] |
| Κωδικός ATC | A10BK03 ,A10BD19, A10BD20 |
| PubChem | CID 11949646 |
| IUPHAR/BPS | 4754 |
| DrugBank | DB09038 |
| ChemSpider | 10123957 |
| UNII | HDC1R2M35U |
| KEGG | D10459 |
| ChEBI | CHEBI:82720 |
| ChEMBL | CHEMBL2107830 |
| Χημικά στοιχεία | |
| Χημικός τύπος | C23H27ClO7 |
| Μοριακή μάζα | 450,91 g·mol−1 |
C1COCC1OC2=CC=C(C=C2)CC3=C(C=CC(=C3)C4C(C(C(C(O4)CO)O)O)O)Cl | |
InChI=1S/C23H27ClO7/c24-18-6-3-14(23-22(28)21(27)20(26)19(11-25)31-23)10-15(18)9-13-1-4-16(5-2-13)30-17-7-8-29-12-17/h1-6,10,17,19-23,25-28H,7-9,11-12H2/t17-,19+,20+,21-,22+,23-/m0/s1 Key:OBWASQILIWPZMG-QZMOQZSNSA-N | |
| Φυσικά στοιχεία | |
| Πυκνότητα | 1.398 g/cm3 |
| Σημείο βρασμού | 665 °C (1,229 °F) |
Η εμπαγλιφλοζίνη, που πωλείται με την επωνυμία Jardiance μεταξύ άλλων, είναι ένα αντιδιαβητικό φάρμακο για τη βελτίωση του ελέγχου της γλυκόζης σε άτομα με σακχαρώδη διαβήτη τύπου 2 [7][8][9] και χρησιμοποιείται μαζί με δίαιτα και άσκηση για τη θεραπεία της.[10][11] Μπορεί να συνταγογραφηθεί, αντί για την μετφορμίνη και έχει οφέλη έναντι των σουλφονυλουριών.[12] Μπορεί να χρησιμοποιηθεί μαζί με άλλα φάρμακα, όπως μετφορμίνη ή ινσουλίνη. Δεν συνιστάται για διαβήτη τύπου 1.[10] Επίσης έχει εγκριθεί για χρήση σε ασθενείς με καρδιακή ανεπάρκεια, ανεξάρτητα από διαβητική κατάσταση.[3] Λαμβάνεται από το στόμα.[10]
Συχνές ανεπιθύμητες ενέργειες περιλαμβάνουν λοιμώξεις του ουροποιητικού συστήματος, μυκητιασικές λοιμώξεις της βουβωνικής χώρας, πόνοι στις αρθρώσεις,[10] υπεραερισμό, ανορεξία, κοιλιακό άλγος, ναυτία, έμετο, λήθαργο, αλλαγές νοητικής κατάστασης, υπόταση, οξεία νεφρική βλάβη.[13] Σπανιότερες αλλά πιο σοβαρές ανεπιθύμητες ενέργειες περιλαμβάνουν δερματική λοίμωξη από τη βουβωνική χώρα, που ονομάζεται γάγγραινα του Φουρνιέρ και μια μορφή διαβητικής κετοξέωσης με φυσιολογικά επίπεδα σακχάρου στο αίμα.[14] Δεν συνιστάται η χρήση κατά την εγκυμοσύνη και τον θηλασμό.[12] Η χρήση δεν συνιστάται σε άτομα με σημαντική νεφρική νόσο, αν και μπορεί να βοηθήσει στην επιβράδυνση της εξέλιξης ήπιων νεφρικών προβλημάτων.[11] Τέλος, η χρήση της εμπαγλιφλοζίνης σε ασθενείς με γνωστή καρδιαγγειακή νόσο μπορεί να είναι ευεργετική, αλλά πρέπει να λαμβάνεται υπόψη η αναλογία κινδύνου και οφέλους και η έναρξη της θεραπείας θα πρέπει να εξατομικεύεται. Η εμπαγλιφλοζίνη είναι αναστολέας του συν-μεταφορέα γλυκόζης νατρίου-2 (SGLT-2) και δρα αυξάνοντας την απώλεια σακχάρου στα ούρα.[8]
Η εμπαγλιφλοζίνη εγκρίθηκε για ιατρική χρήση στις Ηνωμένες Πολιτείες και στην Ευρωπαϊκή Ένωση το 2014.[3][10][15][16] . Το 2021, ήταν το 85ο πιο συχνά συνταγογραφούμενο φάρμακο στις Ηνωμένες Πολιτείες, με περισσότερες από 8 εκατομμύρια συνταγές.[17] [18] Έχει λάβει έγκριση ως γενόσημο φάρμακο από τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ (FDA).[19]
Ιατρικές χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Διαβήτης τύπου 2
[Επεξεργασία | επεξεργασία κώδικα]Η εμπαγλιφλοζίνη χρησιμοποιείται σε συνδυασμό με τη σωστή διατροφή και άσκηση για να βοηθήσει άτομα με διαβήτη τύπου 2 μειώνει τα επίπεδα σακχάρου στο αίμα τους.[6] Μπορεί να χρησιμοποιηθεί παράλληλα με άλλα φάρμακα τύπου 2 διαβήτης όπως μετφορμίνη, σουλφονυλουρίες και ινσουλίνη.[20] Σε σύγκριση με εικονικό φάρμακο, η εμπαγλιφλοζίνη οδήγησε σε πτώση 0,7% στην αιμοσφαιρίνη A1c, μακροπρόθεσμος δείκτης των επιπέδων γλυκόζης στο αίμα.[21]
Η εμπαγλιφλοζίνη προκαλεί μέτριες μειώσεις της αρτηριακής πίεσης και του σωματικού βάρους. Αυτές οι επιδράσεις πιθανόν οφείλονται στην απέκκριση της γλυκόζης στα ούρα και σε μια μικρή αύξηση στην απέκκριση νατρίου στα ούρα.[21][22] Σε κλινικές δοκιμές, οι ασθενείς που έλαβαν εμπαγλιφλοζίνη έχασαν κατά μέσο όρο το 2% του σωματικού τους βάρους.[23] Ένα ψηλότερο ποσοστό ατόμων που έλαβαν εμπαγλιφλοζίνη πέτυχαν απώλεια βάρους μεγαλύτερο από 5% από την αρχική τους τιμή. Το φάρμακο μείωσε τη συστολική αρτηριακή πίεση κατά 3 έως 5 χιλιοστά υδραργύρου (mmHg). Οι επιδράσεις στην αρτηριακή πίεση και το σωματικό βάρος θεωρούνται γενικά ευνοϊκές, καθώς πολλοί ασθενείς με τύπο 2 διαβήτης έχουν υψηλή αρτηριακή πίεση ή είναι υπέρβαροι ή παχύσαρκοι.[24][25]
Οι αναστολείς του SGLT2, συμπεριλαμβανομένης της εμπαγλιφλοζίνης, φαίνεται να μειώνουν την πιθανότητα νοσηλείας για καρδιακή ανεπάρκεια ή την εξέλιξη της χρόνιας νεφρικής νόσου σε άτομα με τύπο 2 διαβήτης. Η εμπαγλιφλοζίνη μπορεί να μειώσει την πιθανότητα θανάτου λόγω καρδιαγγειακών αιτιών σε άτομα με τύπο 2 διαβήτης που έχουν γνωστή καρδιαγγειακή νόσο.[26][27] Μια ανησυχία σχετικά με την κλινική δοκιμή στην οποία βασίζονται αυτοί οι ισχυρισμοί είναι ότι τα διάφορα σκέλη έλαβαν διαφορετικές ποσότητες άλλων φαρμάκων. Επομένως, ο μειωμένος κίνδυνος δεν μπορεί απαραίτητα να αποδοθεί στην εμπαγλιφοζίνη.[28]
Οδηγίες θεραπείας
[Επεξεργασία | επεξεργασία κώδικα]Οι κατευθυντήριες γραμμές της Αμερικανικής Ένωσης Διαβήτη (ADA) και της Ευρωπαϊκής Ένωσης για τη Μελέτη του Διαβήτη (EASD) συνιστούν αναστολείς SGLT-2 όπως η εμπαγλιφλοζίνη ως φάρμακα δεύτερης γραμμής μετά τη μετφορμίνη για τον τύπο 2 διαβήτης σε άτομα με καρδιακή ανεπάρκεια ή χρόνια νεφρική νόσο.[11] Για διαβήτη τύπου 2 με καθιερωμένη καρδιαγγειακή νόσο, οι οδηγίες προτείνουν είτε έναν αναστολέα SGLT-2 είτε έναν αγωνιστή GLP-1 ως φάρμακα δεύτερης γραμμής μετά τη μετφορμίνη. Σε όλες τις άλλες περιπτώσεις διαβήτη τύπου 2, οι αναστολείς SGLT-2 όπως η εμπαγλιφλοζίνη μπορεί να είναι κατάλληλες επιλογές δεύτερης γραμμής εάν ο έλεγχος της γλυκόζης στο αίμα ή η απώλεια βάρους είναι προτεραιότητες θεραπείας. Είναι λιγότερο κατάλληλα εάν το κόστος αποτελεί σημαντικό παράγοντα.
Στο Ηνωμένο Βασίλειο, η εμπαγλιφλοζίνη συνιστάται μόνο μαζί με μετφορμίνη εάν δεν μπορεί να ληφθεί σουλφονυλουρία.[20]
Διαβήτης τύπου 1
[Επεξεργασία | επεξεργασία κώδικα]Η εμπαγλιφλοζίνη δεν συνιστάται για διαβήτη τύπου 1.[10] Μία μελέτη μελέτησε τη χρήση της εκτός από την ινσουλίνη σε άτομα με διαβήτη τύπου 1.[29] Τα φάρμακα παρουσίασαν μέτριες βελτιώσεις στον έλεγχο της γλυκόζης στο αίμα και στο σωματικό βάρος, αλλά συσχετίστηκαν με αυξημένο κίνδυνο διαβητικής κετοξέωσης, μια επικίνδυνη επιπλοκή του διαβήτη. Η εμπαγλιφλοζίνη δεν έχει εγκριθεί από την Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων (FDA) για χρήση σε διαβήτη τύπου 1.[6]
Καρδιακή ανεπάρκεια
[Επεξεργασία | επεξεργασία κώδικα]Η εμπαγλιφλοζίδη έχει λάβει έγκριση για χρήση σε ασθενείς με καρδιακή ανεπάρκεια με μειωμένο κλάσμα εξώθηση.[3][6] Τυχαιοποιημένη διπλά τυφλή μελέτη ότι μειώνει τόσο τις νοσηλείες εξαιτίας καρδιακής ανεπάρκειας όσο και τους θανάτους από καρδιαγγειακή νόσο σε σχέση με την ομάδα ελέγχου τόσο σε ασθενείς τόσο με όσο και χωρίς σακχαρώδη διαβήτη κατά περίπου 25%. Επίσης, οι ασθενείς που λάμβαναν εμπαγλιφλοζίνη παρουσίασαν μικρότερη μείωση του ρυθμού σπειραματικής διήθησης σε σχέση με την ομάδα ελέγχου.[30] Έτσι, η ευρωπαϊκή καρδιολογική εταιρεία συμπεριέλαβε την εμπαγλιφλοζίδη και την δαπαγλιφλοζίδη στα φάρμακα που μπορούν να δοθούν για την αντιμετώπιση της καρδιακής ανεπάρκειας με μειωμένο κλάσμα εξώθησης.[31]
Αντενδείξεις
[Επεξεργασία | επεξεργασία κώδικα]- Ιστορικό σοβαρής αλλεργικής αντίδρασης στην εμπαγλιφλοζίνη[6]
- Νεφρική νόσος τελικού σταδίου
- Διαβητική κετοξέωση
Παρενέργειες
[Επεξεργασία | επεξεργασία κώδικα]Κοινές
[Επεξεργασία | επεξεργασία κώδικα]- Η εμπαγλιφλοζίνη αυξάνει τον κίνδυνο μυκητιασικών λοιμώξεων των γεννητικών οργάνων. Ο κίνδυνος είναι υψηλότερος σε άτομα με προηγούμενο ιστορικό μυκητιασικών λοιμώξεων.[21]
- Οι λοιμώξεις του ουροποιητικού συστήματος (UTI) μπορεί να είναι πιο συχνές με την εμπαγλιφλοζίνη. Ορισμένες μεμονωμένες κλινικές δοκιμές έχουν δείξει αυξημένο κίνδυνο, αλλά τα σωρευτικά δεδομένα σε πολλές δοκιμές δεν δείχνουν αύξηση του κινδύνου UTI.[23][24]
- Η εμπαγλιφλοζίνη μειώνει τη συστολική και διαστολική αρτηριακή πίεση και μπορεί να αυξήσει τον κίνδυνο χαμηλής αρτηριακής πίεσης, η οποία μπορεί να προκαλέσει λιποθυμία και / ή πτώση. Ο κίνδυνος είναι υψηλότερος σε ηλικιωμένα άτομα, άτομα που λαμβάνουν διουρητικά και άτομα με μειωμένη νεφρική λειτουργία.
- Ελαφρές αυξήσεις της χοληστερόλης LDL παρατηρούνται με την εμπαγλιφλοζίνη, κυμαινόμενες από 2% έως 4% από την έναρξη.
Σοβαρές
[Επεξεργασία | επεξεργασία κώδικα]- Η διαβητική κετοξέωση (ΔΚΟ), μια σπάνια αλλά δυνητικά απειλητική για τη ζωή κατάσταση, μπορεί να εμφανιστεί πιο συχνά με την εμπαγλιφλοζίνη και άλλους αναστολείς SGLT-2.[32][33] Ενώ η ΔΚΟ συνήθως σχετίζεται με αυξημένα επίπεδα γλυκόζης στο αίμα, σε άτομα που λαμβάνουν αναστολείς SGLT-2, η ΔΚΟ μπορεί να παρατηρηθεί με μη φυσιολογικά φυσιολογικά επίπεδα γλυκόζης στο αίμα, ένα φαινόμενο που ονομάζεται ευγλυκαιμική κετοξέωση. Η απουσία αυξημένων επιπέδων γλυκόζης στο αίμα σε άτομα με αναστολέα SGLT-2 μπορεί να δυσκολέψει τη διάγνωση της ΔΚΟ. Ο κίνδυνος ΔΚΟ που σχετίζεται με την εμπαγλιφλοζίνη μπορεί να είναι υψηλότερος στο περιβάλλον ασθένειας, αφυδάτωσης, χειρουργικής επέμβασης και / ή κατανάλωσης αλκοόλ. Φαίνεται επίσης σε διαβήτη τύπου 1 που λαμβάνουν εμπαγλιφλοζίνη, η οποία είναι κυρίως μια μη εγκεκριμένη ή «εκτός σήμανσης» χρήση του φαρμάκου. Για να μειώσει τον κίνδυνο εμφάνισης κετοξέωσης (μια σοβαρή κατάσταση στην οποία ο οργανισμός παράγει υψηλά επίπεδα οξέων αίματος που ονομάζονται κετόνες) μετά τη χειρουργική επέμβαση, ο FDA ενέκρινε αλλαγές στις πληροφορίες συνταγογράφησης για τα φάρμακα για τον διαβήτη αναστολέα SGLT2 για να συστήσει την προσωρινή διακοπή τους πριν από την προγραμματισμένη χειρουργική. Η εμπαγλιφλοζίνη πρέπει να σταματά κάθε μία τουλάχιστον τρεις ημέρες πριν από την προγραμματισμένη χειρουργική επέμβαση.[34] Τα συμπτώματα της κετοξέωσης περιλαμβάνουν ναυτία, έμετο, κοιλιακό άλγος, κόπωση και δυσκολία στην αναπνοή.
- Γάγγραινα του Φουρνιέ, μια σπάνια αλλά σοβαρή λοίμωξη της βουβωνικής χώρας, εμφανίζεται συχνότερα σε άτομα που λαμβάνουν εμπαγλιφλοζίνη και άλλους αναστολείς SGLT-2.[10][14] Τα συμπτώματα περιλαμβάνουν πυρετό, γενική αίσθηση αδιαθεσίας και πόνο ή πρήξιμο γύρω από τα γεννητικά όργανα ή στο δέρμα πίσω από αυτά. Η λοίμωξη εξελίσσεται γρήγορα και συνιστάται επείγουσα ιατρική φροντίδα.
- Η εμπαγλιφλοζίνη μπορεί να αυξήσει τον κίνδυνο χαμηλού σακχάρου στο αίμα όταν χρησιμοποιείται μαζί με σουλφονυλουρία ή ινσουλίνη.[35] Όταν χρησιμοποιείται από μόνη της ή μαζί με μετφορμίνη, δεν φαίνεται να αυξάνει τον κίνδυνο υπογλυκαιμίας.[24]
Μηχανισμός δράσης
[Επεξεργασία | επεξεργασία κώδικα]Η εμπαγλιφλοζίνη είναι ένας αναστολέας του συν-μεταφορέα γλυκόζης νατρίου-2 (SGLT-2), ο οποίος βρίσκεται σχεδόν αποκλειστικά στα εγγύς σωληνάρια νεφρονικών συστατικών στα νεφρά. Ο SGLT-2 αντιπροσωπεύει περίπου 90 τοις εκατό της επαναπορρόφησης της γλυκόζης στο αίμα. Ο αποκλεισμός του SGLT-2 μειώνει τη γλυκόζη στο αίμα εμποδίζοντας την επαναπορρόφηση της γλυκόζης στο νεφρό και έτσι εκκρίνει τη γλυκόζη μέσω των ούρων.[36][37][38]
Παράλληλα εμποδίζεται και η επαναρρόφηση νατρίου, με αποτέλεσμα την απέκκριση νατρίου στα ούρα με αποτέλεσμα να έχει και διουρητική δράση. Όσον αφορά τα προστατευτικά αποτελέσματά του στην καρδιακή ανεπάρκεια, αυτό αποδίδεται κυρίως σε αιμοδυναμικές επιδράσεις, όπου οι αναστολείς SGLT2 μειώνουν δραστικά τον ενδοαγγειακό όγκο μέσω της οσμωτικής διούρησης και της νατριουρίας. Αυτό συνεπώς μπορεί να οδηγήσει σε μείωση του προφορτίου και του μεταφορτίου, μειώνοντας έτσι τον καρδιακό φόρτο εργασίας και βελτιώνοντας τη λειτουργία της αριστερής κοιλίας.[39][40]
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Αναπτύχθηκε από τις Boehringer Ingelheim και Eli Lilly and Company. Διατίθεται επίσης ως συνδυασμός με λιναγλιπτίνη και μετφορμίνη.
Από τον Μάιο του 2013, οι Boehringer και Lilly είχαν υποβάλει αιτήσεις έγκρισης εμπορείας στον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) και στην Υπηρεσία Τροφίμων και Φαρμάκων των ΗΠΑ (FDA).[41] Το φάρμακο εγκρίθηκε στην Ευρώπη τον Μάιο του 2014,[3] και εγκρίθηκε από το FDA τον Αύγουστο του 2014.[15][42] Ο FDA απαιτούσε τέσσερις μελέτες μετά την κυκλοφορία: μια δοκιμή καρδιαγγειακών αποτελεσμάτων, δύο μελέτες σε παιδιά και μια μελέτη τοξικότητας σε ζώα που σχετίζονται με παιδιατρικές δοκιμές.
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 «Empagliflozin (Jardiance) Use During Pregnancy». Drugs.com. 30 Αυγούστου 2018. Ανακτήθηκε στις 10 Φεβρουαρίου 2020.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 «Empagliflozin». DRUGBANK Online. 1 Απριλίου 2015. Ανακτήθηκε στις 11 Ιανουαρίου 2024.
- ↑ 3,0 3,1 3,2 3,3 3,4 «Jardiance EPAR». European Medicines Agency (EMA). 7 Δεκεμβρίου 2021. Ανακτήθηκε στις 11 Ιανουαρίου 2022.
- ↑ «Jardiance 10 mg film-coated tablets – Summary of Product Characteristics (SmPC)». (emc). Ανακτήθηκε στις 10 Φεβρουαρίου 2020.
- ↑ «Jardiance 25 mg film-coated tablets – Summary of Product Characteristics (SmPC)». (emc). 23 Οκτωβρίου 2019. Ανακτήθηκε στις 10 Φεβρουαρίου 2020.
- ↑ 6,0 6,1 6,2 6,3 6,4 «Jardiance- empagliflozin tablet, film coated». DailyMed. 22 Ιανουαρίου 2020. Ανακτήθηκε στις 10 Φεβρουαρίου 2020.
- ↑ «JARDIANCE- empagliflozin tablet, film coated». dailymed.nlm.nih.gov. Ανακτήθηκε στις 13 Ιανουαρίου 2024.
- ↑ 8,0 8,1 «Empagliflozin Monograph for Professionals». Drugs.com (στα Αγγλικά). AHFS. Αρχειοθετήθηκε από το πρωτότυπο στις 6 Απριλίου 2019. Ανακτήθηκε στις 13 Ιανουαρίου 2024.
- ↑ Davies, Melanie J.; D’Alessio, David A.; Fradkin, Judith; Kernan, Walter N.; Mathieu, Chantal; Mingrone, Geltrude; Rossing, Peter; Tsapas, Apostolos και άλλοι. (2018-12-01). «Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD)» (στα αγγλικά). Diabetologia 61 (12): 2461–2498. doi:. ISSN 1432-0428. https://doi.org/10.1007/s00125-018-4729-5.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 «Empagliflozin Monograph for Professionals». Drugs.com (στα Αγγλικά). AHFS. Αρχειοθετήθηκε από το πρωτότυπο στις 6 Απριλίου 2019. Ανακτήθηκε στις 13 Ιανουαρίου 2024.
- ↑ 11,0 11,1 11,2 «Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD)». Diabetologia 61 (12): 2461–2498. December 2018. doi:. PMID 30288571.
- ↑ 12,0 12,1 British national formulary: BNF 76 (76 έκδοση). Pharmaceutical Press. 2018. σελ. 691. ISBN 9780857113382.
- ↑ «Empagliflozin Monograph for Professionals». Drugs.com (στα Αγγλικά). AHFS. Αρχειοθετήθηκε από το πρωτότυπο στις 6 Απριλίου 2019. Ανακτήθηκε στις 13 Ιανουαρίου 2024.
- ↑ 14,0 14,1 «FDA warns about rare occurrences of a serious infection of the genital area with SGLT2 inhibitors for diabetes». U.S. Food and Drug Administration (FDA). 9 Φεβρουαρίου 2019. Ανακτήθηκε στις 18 Μαρτίου 2019.
- ↑ 15,0 15,1 «Drug Approval Package: Jardiance (empagliflozin) Tablets NDA #204629». U.S. Food and Drug Administration (FDA). 8 Σεπτεμβρίου 2014. Ανακτήθηκε στις 10 Φεβρουαρίου 2020.
- ↑ «Jardiance: FDA-Approved Drugs». U.S. Food and Drug Administration (FDA). Ανακτήθηκε στις 10 Φεβρουαρίου 2020.
- ↑ «The Top 300 of 2021». clincalc.com. Αρχειοθετήθηκε από το πρωτότυπο στις 13 Απριλίου 2020. Ανακτήθηκε στις 13 Ιανουαρίου 2024.
- ↑ «Empagliflozin - Drug Usage Statistics, ClinCalc DrugStats Database». clincalc.com. Αρχειοθετήθηκε από το πρωτότυπο στις 13 Απριλίου 2020. Ανακτήθηκε στις 13 Ιανουαρίου 2024.
- ↑ Research, Center for Drug Evaluation and (2023-03-03). «2022 First Generic Drug Approvals» (στα αγγλικά). FDA. https://www.fda.gov/drugs/drug-and-biologic-approval-and-ind-activity-reports/2022-first-generic-drug-approvals.
- ↑ 20,0 20,1 «Empagliflozin in combination therapy for treating type 2 diabetes». NICE. Guidance and guidelines. 25 Μαρτίου 2015. Ανακτήθηκε στις 21 Δεκεμβρίου 2018.
- ↑ 21,0 21,1 21,2 «Empagliflozin (Jardiance) National Drug Monograph» (PDF). VA Pharmacy Benefits Management Services, Medical Advisory Panel, and VISN Pharmacist Executives. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 5 Αυγούστου 2019. Ανακτήθηκε στις 12 Μαρτίου 2021.
- ↑ «SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state-of-the-art review». Diabetologia 61 (10): 2108–2117. October 2018. doi:. PMID 30132036.
- ↑ 23,0 23,1 «Empagliflozin (Jardiance) for type 2 diabetes mellitus». American Family Physician 94 (12): 1014–1015. December 2016. PMID 28075091. https://www.aafp.org/afp/2016/1215/p1014.html.
- ↑ 24,0 24,1 24,2 «Empagliflozin: Role in treatment options for patients with type 2 diabetes mellitus». Diabetes Therapy 8 (1): 33–53. February 2017. doi:. PMID 27837465.
- ↑ «Obesity and overweight fact sheet» (PDF). World Health Organization.
- ↑ «SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: A systematic review and meta-analysis of cardiovascular outcome trials». Lancet 393 (10166): 31–39. January 2019. doi:. PMID 30424892.
- ↑ «Sodium-glucose co-transporter 2 inhibitors and cardiovascular outcomes: A systematic review and meta-analysis». European Journal of Preventive Cardiology 25 (5): 495–502. March 2018. doi:. PMID 29372664.
- ↑ «EMPA-REG Outcome trial: What does it mean?» (PDF). Therapeutics Initiative. Ιουλίου–Αυγούστου 2017. Ανακτήθηκε στις 21 Δεκεμβρίου 2018.
- ↑ «SGLT Inhibitors for Type 1 Diabetes: An obvious choice, or too good to be true?». Diabetes Care 41 (12): 2444–2447. December 2018. doi:. PMID 30459245. http://care.diabetesjournals.org/content/41/12/2444.
- ↑ Packer, Milton; Anker, Stefan D.; Butler, Javed; Filippatos, Gerasimos; Pocock, Stuart J.; Carson, Peter; Januzzi, James; Verma, Subodh και άλλοι. (2020-10-08). «Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure». New England Journal of Medicine 383 (15): 1413–1424. doi:. ISSN 0028-4793. PMID 32865377. https://doi.org/10.1056/NEJMoa2022190.
- ↑ McDonagh, Theresa A; Metra, Marco; Adamo, Marianna; Gardner, Roy S; Baumbach, Andreas; Böhm, Michael; Burri, Haran; Butler, Javed και άλλοι. (2021-09-21). «2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure» (στα αγγλικά). European Heart Journal 42 (36): 3599–3726. doi:. ISSN 0195-668X. https://academic.oup.com/eurheartj/article/42/36/3599/6358045.
- ↑ «Euglycemic diabetic ketoacidosis: A predictable, detectable, and preventable safety concern with SGLT2 inhibitors». Diabetes Care 38 (9): 1638–1642. September 2015. doi:. PMID 26294774.
- ↑ «American Association of Clinical Endocrinologists and American College of Endocrinology Position Statement on the Association of Sglt-2 Inhibitors and Diabetic Ketoacidosis». Endocrine Practice 22 (6): 753–762. June 2016. doi:. PMID 27082665.
- ↑ «FDA revises labels of SGLT2 inhibitors for diabetes to include warning». U.S. Food and Drug Administration. 19 Μαρτίου 2020. Ανακτήθηκε στις 6 Ιουνίου 2020.
 Αυτό το λήμμα περιλαμβάνει κείμενο από αυτή την πηγή, που είναι κοινό κτήμα.
Αυτό το λήμμα περιλαμβάνει κείμενο από αυτή την πηγή, που είναι κοινό κτήμα.
- ↑ «Empagliflozin in combination therapy for treating type 2 diabetes». NICE. 25 Μαρτίου 2015. Ανακτήθηκε στις 21 Δεκεμβρίου 2018.
- ↑ «Inhibition of renal glucose reabsorption: A novel strategy for achieving glucose control in type 2 diabetes mellitus». Endocrine Practice 14 (6): 782–790. September 2008. doi:. PMID 18996802.
- ↑ «Sodium glucose cotransporter 2 inhibitors as a new treatment for diabetes mellitus». The Journal of Clinical Endocrinology and Metabolism 95 (1): 34–42. January 2010. doi:. PMID 19892839.
- ↑ «From victim to ally: The kidney as an emerging target for the treatment of diabetes mellitus». Current Medical Research and Opinion 25 (3): 671–681. March 2009. doi:. PMID 19232040.
- ↑ «The effects of sodium-glucose cotransporter 2 inhibitors on left ventricular function: current evidence and future directions». ESC Heart Fail 6 (5): 927–935. October 2019. doi:. PMID 31400090.
- ↑ Jackson, Alice M.; Dewan, Pooja; Anand, Inder S.; Bělohlávek, Jan; Bengtsson, Olof; de Boer, Rudolf A.; Böhm, Michael; Boulton, David W. και άλλοι. (2020-09-15). «Dapagliflozin and Diuretic Use in Patients With Heart Failure and Reduced Ejection Fraction in DAPA-HF» (στα αγγλικά). Circulation 142 (11): 1040–1054. doi:. ISSN 0009-7322. PMID 32673497. PMC PMC7664959. https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.047077.
- ↑ Tucker, Miriam E. (7 Μαΐου 2013). «First details of empagliflozin trials follow US and EU filings». Medscape Medical News.
- ↑ Mechatie, Elizabeth (1 Αυγούστου 2014). «FDA approves empagliflozin for adults with type 2 diabetes». Clinical Endocrinology News Digital Network.
