Νιτρώδες ιόν
| |||
| Ονόματα | |||
|---|---|---|---|
| ΟνοματολογίαIUPAC
Νιτρώδες
| |||
| ΆλλαΟνόματα
Νιτρώδες
| |||
| Αναγνωριστικά | |||
| 14797-65-0 | |||
| ChEBI | CHEBI:16301 | ||
| ChemSpider | 921 | ||
| Αριθμός_EC | 233-272-6 | ||
InChI=1S/HNO2/c2-1-3/h(H,2,3)/p-1 Key: IOVCWXUNBOPUCH-UHFFFAOYSA-M InChI=1/HNO2/c2-1-3/h(H,2,3)/p-1 Key: IOVCWXUNBOPUCH-REWHXWOFAR | |||
| Jmol 3Δ Πρότυπο | Image | ||
| PubChem | 946 | ||
N(=O)[O-] | |||
| UNII | J39976L608 | ||
| Ιδιότητες | |||
| NO− 2 | |||
| Μοριακή μάζα | 46,01 g·mol−1 | ||
| ΣυζυγέςΟξύ | Νιτρώδες οξύ | ||
Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες (25°C, 100 kPa). | |||
| Infobox references | |||
Το νιτρώδες ιόν έχει τον χημικό τύπο NO−
2. Τα νιτρώδη (κυρίως νιτρώδες νάτριο) χρησιμοποιούνται ευρέως σε όλες τις χημικές και φαρμακευτικές βιομηχανίες.[1] Το νιτρώδες ανιόν είναι ένα εκτεταμένο ενδιάμεσο στον κύκλο του αζώτου στη φύση. Το όνομα νιτρώδες αναφέρεται επίσης σε οργανικές ενώσεις που έχουν την ομάδα –ONO, οι οποίες είναι εστέρες του νιτρώδους οξέος.
Παρασκευή
[Επεξεργασία | επεξεργασία κώδικα]Το νιτρώδες νάτριο παράγεται βιομηχανικά με τη διοχέτευση ενός μείγματος οξειδίων του αζώτου σε υδατικό διάλυμα υδροξείδιο του νατρίου ή ανθρακικού νατρίου:[2][1]
- NO + NO2 + 2 NaOH → 2 NaNO2 + H2O
- NO + NO2 + Na2CO3 → 2 NaNO2 + CO2
Το προϊόν καθαρίζεται με ανακρυστάλλωση. Τα νιτρώδη αλκαλιμέταλλα είναι θερμικά σταθερά μέχρι και πέρα από το σημείο τήξης τους (441 °C για το KNO2). Το νιτρώδες αμμώνιο μπορεί να παρασκευαστεί από διάζωτο τριοξείδιο (τριοξείδιο του διαζώτου (dinitrogen trioxide), N2O3, που τυπικά είναι ο ανυδρίτης του νιτρώδους οξέος:
- 2 NH3 + H2O + N2O3 → 2 NH4NO2
Δομή
[Επεξεργασία | επεξεργασία κώδικα]
2, που συνεισφέρουν στο υβρίδιο συντονισμού για το νιτρώδες ιόν
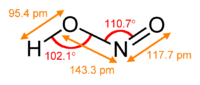
Το νιτρώδες ιόν έχει συμμετρική δομή (C2v, με τους δύο δεσμούς N–O να έχουν ίσο μήκος και γωνία δεσμού περίπου 115°. Στη θεωρία δεσμού σθένους (valence bond theory), περιγράφεται ως υβρίδιο συντονισμού με ίσες συνεισφορές από τις δύο κανονικές μορφές που είναι κατοπτρικές εικόνες η μία της άλλης. Στη μοριακή τροχιακή θεωρία (molecular orbital theory), υπάρχει ένας δεσμός σ μεταξύ κάθε ατόμου οξυγόνου και του ατόμου αζώτου και ένας απεντοπισμένος δεσμός π που δημιουργείται από τα τροχιακά p σε άτομα αζώτου και οξυγόνου που είναι κάθετα στο επίπεδο του μορίου. Το αρνητικό φορτίο του ιόντος κατανέμεται εξίσου στα δύο άτομα οξυγόνου. Και τα άτομα αζώτου και οξυγόνου φέρουν ένα μονήρες ζεύγος ηλεκτρονίων. Επομένως, το νιτρώδες ιόν είναι μια βάση Λιούις. Στην αέρια φάση υπάρχει κυρίως ως trans-επίπεδο μόριο.
Αντιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Ιδιότητες οξέος-βάσης
[Επεξεργασία | επεξεργασία κώδικα]Τα νιτρώδη είναι η συζυγής βάση του ασθενούς οξέος νιτρώδες οξύ:
Το νιτρώδες οξύ είναι επίσης πολύ πτητικό, τείνει να αυτοοξειδοανάγεται:
- 3 HNO2 (aq)
 H3O+ + NO−
H3O+ + NO−
3 + 2 NO
Αυτή η αντίδραση είναι αργή στους 0 °C.[2] Η προσθήκη οξέος σε διάλυμα νιτρώδους άλατος παρουσία αναγωγικού μέσου, όπως ο σίδηρος(II), είναι ένας τρόπος για να παρασκευαστεί μονοξείδιο του αζώτου (ΝΟ) στο εργαστήριο.
Οξείδωση και αναγωγή
[Επεξεργασία | επεξεργασία κώδικα]Ο τυπικός αριθμός οξείδωσης του ατόμου αζώτου στα νιτρώδη είναι +3. Αυτό σημαίνει ότι μπορεί είτε να οξειδωθεί σε καταστάσεις οξείδωσης +4 και +5, είτε να αναχθεί σε καταστάσεις οξείδωσης τόσο χαμηλές όσο -3. Τα τυπικά κανονικά δυναμικά οξειδοαναγωγής για αντιδράσεις που περιλαμβάνουν άμεσα νιτρώδες οξύ φαίνονται στον παρακάτω πίνακα:[4]
Ημιαντίδραση E0 (V) NO−
3 + 3 H+ + 2 e− HNO2 + H2O
HNO2 + H2O+0.94 2 HNO2 + 4 H+ + 4 e−  H2N2O2 + 2 H2O
H2N2O2 + 2 H2O+0.86 N2O4 + 2 H+ + 2 e−  2 HNO2
2 HNO2+1.065 2 HNO2+ 4 H+ + 4 e−  N2O + 3 H2O
N2O + 3 H2O+1.29
Τα δεδομένα μπορούν να επεκταθούν για να συμπεριλάβουν προϊόντα σε χαμηλότερους αριθμούς οξείδωσης. Για παράδειγμα:
- H2N2O2 + 2 H+ + 2 e−
 N2 + 2 H2O; E0 = +2.65 V
N2 + 2 H2O; E0 = +2.65 V
Οι αντιδράσεις οξείδωσης συνήθως καταλήγουν στο σχηματισμό του νιτρικού ιόντος, με το άζωτο σε κατάσταση οξείδωσης +5. Για παράδειγμα, η οξείδωση με υπερμαγγανικό (permanganate) ιόν μπορεί να χρησιμοποιηθεί για ποσοτική ανάλυση νιτρωδών (με τιτλοδότηση (titration)):
- 5 NO−
2 + 2 MnO−
4 + 6 H+ → 5 NO−
3 + 2 Mn2+ + 3 H2O
Το προϊόν των αντιδράσεων αναγωγής με ιόντα νιτρωδών αλάτων ποικίλλει, ανάλογα με το αναγωγικό μέσο που χρησιμοποιείται και την ισχύ του. Με το διοξείδιο του θείου, τα προϊόντα είναι NO και N2O, με κασσίτερο(II) (Sn2+) το προϊόν είναι υπονιτρώδες οξύ (hyponitrous acid) (H2N2O2 ). Η αναγωγή μέχρι την αμμωνία (NH3) συμβαίνει με το υδρόθειο. Με το κατιόν υδραζίνιο (N2H+
5) το προϊόν της αναγωγής των νιτρωδών είναι υδραζωτικό οξύ (hydrazoic acid) (HN3) , μια ασταθής και εκρηκτική ένωση:
- HNO2 + N2H+
5 → HN3 + H2O + H3O+
το οποίο μπορεί επίσης να αντιδράσει περαιτέρω με τα νιτρώδη:
- HNO2 + HN3 → N2O + N2 + H2O
Αυτή η αντίδραση είναι ασυνήθιστη στο ότι περιλαμβάνει ενώσεις με άζωτο με τέσσερις διαφορετικούς αριθμούς οξείδωσης.[2]
Ανάλυση νιτρώδους ιόντος
[Επεξεργασία | επεξεργασία κώδικα]Τα νιτρώδη ανιχνεύονται και αναλύονται με την αντίδραση Griess, που περιλαμβάνει τον σχηματισμό ενός βαθέος κόκκινου χρώματος αζωχρωστικής κατά την επεξεργασία ενός δείγματος που περιέχει NO−
2 με σουλφανιλικό οξύ (sulfanilic acid) και ναφθυλ-1-αμίνη παρουσία οξέος.[5]
Σύμπλοκα συναρμογής
[Επεξεργασία | επεξεργασία κώδικα]Τα νιτρώδη είναι ένας αμφισχιδής προσδέτης (ambidentate ligand) και μπορεί να σχηματίσει μια μεγάλη ποικιλία από σύμπλοκα συναρμογής δεσμεύοντας τους σε μεταλλικά ιόντα με διάφορους τρόπους [2]. Δύο παραδείγματα είναι το κόκκινο νιτρώδες σύμπλοκο [Co(NH3)5(ONO)] 2+ που είναι μετασταθές (metastable), και ισομεριώνεται στο κίτρινο σύμπλοκο [Co(NH3)5(NO2)]2+] . Τα νιτρώδη επεξεργάζονται από διάφορα ένζυμα, τα οποία όλα χρησιμοποιούν σύμπλοκα συναρμογής.
Βιοχημεία
[Επεξεργασία | επεξεργασία κώδικα]
Στη νιτροποίηση (nitrification), το αμμώνιο μετατρέπεται σε νιτρώδες. Στα σημαντικά είδη περιλαμβάνονται το Nitrosomonas. Άλλα βακτηριακά είδη όπως το νιτροβακτήριο, Nitrobacter, είναι υπεύθυνα για την οξείδωση των νιτρωδών σε νιτρικά. Τα νιτρώδη μπορούν να αναχθούν σε μονοξείδιο του αζώτου ή αμμωνία από πολλά είδη βακτηρίων. Υπό συνθήκες υποξίας, τα νιτρώδη μπορεί να απελευθερώσουν μονοξείδιο του αζώτου, το οποίο προκαλεί ισχυρή αγγειοδιαστολή (vasodilation). Έχουν περιγραφεί διάφοροι μηχανισμοί για τη μετατροπή των νιτρωδών σε ΝΟ, συμπεριλαμβανομένης της ενζυμικής αναγωγής από οξειδοαναγωγάση της ξανθίνης, αναγωγάση νιτρωδών και συνθετάση του μονοξειδίου του αζώτου (Nitric oxide synthase, NOS), καθώς και μη ενζυματικές όξινες αντιδράσεις αυτοξειδοαναγωγής.
Χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Χημικός πρόδρομος
[Επεξεργασία | επεξεργασία κώδικα]Αζωχρώματα και άλλες χρωστικές παρασκευάζονται με τη διαδικασία που ονομάζεται διαζώτωση (diazotization), η οποία απαιτεί νιτρώδη.[1]
Νιτρώδη στη συντήρηση και τη βιοχημεία τροφίμων
[Επεξεργασία | επεξεργασία κώδικα]Η προσθήκη νιτρωδών και νιτρικών σε επεξεργασμένα κρέατα όπως το ζαμπόν, το μπέικον και τα λουκάνικα μειώνει την ανάπτυξη και την παραγωγή τοξινών του C. botulinum .[8][9] Το νιτρώδες νάτριο χρησιμοποιείται για να επιταχύνει την ωρίμανση του κρέατος και επίσης να προσδώσει ένα ελκυστικό χρώμα.[10] Από την άλλη πλευρά, μια μελέτη του 2018 από τη Βρετανική Ένωση Παραγωγών Κρέατος έδειξε ότι τα νομικά επιτρεπόμενα επίπεδα νιτρωδών δεν έχουν καμία επίδραση στην ανάπτυξη του Clostridium botulinum.[11] Στις Η.Π.Α., το κρέας δεν μπορεί να χαρακτηριστεί ως συντηρημένο χωρίς την προσθήκη νιτρωδών αλάτων.[12][13][14] Σε ορισμένες χώρες, τα αλλαντικά παρασκευάζονται χωρίς νιτρικά ή νιτρώδη και χωρίς νιτρώδη από φυτική προέλευση. Το προσούτο (ζαμπόν Πάρμας), που παράγεται χωρίς νιτρώδη από το 1993, αναφέρθηκε το 2018 ότι δεν προκάλεσε κρούσματα αλλαντίασης.[10] Στα ποντίκια, τα τρόφιμα πλούσια σε νιτρώδη άλατα μαζί με ακόρεστα λίπη μπορούν να αποτρέψουν την αρτηριακή υπέρταση, κάτι που είναι μια εξήγηση για την προφανή επίδραση στην υγεία της μεσογειακής διατροφής.[15] Η προσθήκη νιτρωδών στο κρέας έχει αποδειχθεί ότι παράγει γνωστά καρκινογόνα, ο Παγκόσμιος Οργανισμός Υγείας (ΠΟΥ) συμβουλεύει ότι η κατανάλωση 50 g (1,8 oz) επεξεργασμένου κρέατος με νιτρώδη άλατα την ημέρα θα αυξήσει τον κίνδυνο εμφάνισης καρκίνου του παχέος εντέρου κατά 18% κατά τη διάρκεια της ζωής.[10] Ωστόσο, το 95% των νιτρωδών που προσλαμβάνεται στις σύγχρονες δίαιτες προέρχεται από βακτηριακή μετατροπή νιτρικών αλάτων που βρίσκονται φυσικά στα διαιτητικά λαχανικά.[16] Τα συνιστώμενα μέγιστα όρια από τον Παγκόσμιο Οργανισμό Υγείας στο πόσιμο νερό είναι 3 mg L−1 και 50 mg L−1 για τα νιτρώδη και νιτρικά ιόντα, αντίστοιχα.[17]
Συντήρηση κρέατος
[Επεξεργασία | επεξεργασία κώδικα]Σε μια αντίδραση με τη μυοσφαιρίνη του κρέατος, τα νιτρώδη άλατα δίνουν στο προϊόν ένα επιθυμητό ροζ-κόκκινο φρέσκο χρώμα, όπως στο παστό μοσχαρίσιο κρέας (κορν μπιφ). Στις ΗΠΑ, τα νιτρώδη χρησιμοποιούνται επίσημα από το 1925. Σύμφωνα με επιστήμονες που εργάζονται για την ομάδα βιομηχανίας του Αμερικανικού Ιδρύματος Κρέατος, αυτή η χρήση νιτρωδών ξεκίνησε τον Μεσαίωνα.[18] Ιστορικοί[19] και επιδημιολόγοι[20] υποστηρίζουν ότι η ευρεία χρήση των νιτρωδών αλάτων στην συντήρηση του κρέατος συνδέεται στενά με την ανάπτυξη της βιομηχανικής επεξεργασίας κρέατος. Ο Γάλλος ερευνητής δημοσιογράφος Guillaume Coudray ισχυρίζεται ότι η βιομηχανία κρέατος επιλέγει να θεραπεύει τα κρέατά της με νιτρώδη άλατα, παρόλο που έχει αποδειχθεί ότι αυτή η χημική ουσία προκαλεί καρκινογόνες νιτρωδοενώσεις.[21] Ορισμένοι παραδοσιακοί και βιοτεχνικοί παραγωγοί αποφεύγουν τα νιτρώδη.
Αντίδοτο για δηλητηρίαση από κυάνιο
[Επεξεργασία | επεξεργασία κώδικα]Τα νιτρώδη άλατα με τη μορφή νιτρώδους νατρίου και νιτρώδους αμυλίου είναι συστατικά πολλών συνόλων αντιδότων κυανίου.[22] Και οι δύο αυτές ενώσεις συνδέονται με αιμοσφαιρίνη και οξειδώνουν τα ιόντα Fe2+ σε ιόντα Fe3+ σχηματίζοντας μεθαιμοσφαιρίνη (methemoglobin). Η μεθαιμοσφαιρίνη με τη σειρά της δεσμεύεται στο κυάνιο (CN) δημιουργώντας κυανομεθαιμοσφαιρίνη, αφαιρώντας αποτελεσματικά το κυάνιο από το σύμπλεγμα IV της αλυσίδας μεταφοράς ηλεκτρονίων (electron transport chain, ETC) στο μιτοχόνδρια, που είναι η κύρια θέση της διαταραχής που προκαλείται από το κυάνιο. Ένας άλλος μηχανισμός με τον οποίο τα νιτρώδη είναι χρήσιμα στη θεραπεία της τοξικότητας των κυανιδίων είναι η παραγωγή μονοξειδίου του αζώτου (ΝΟ). Το ΝΟ εκτοπίζει το CN από την οξειδάση του κυτοχρώματος c (σύμπλοκο IV), καθιστώντας το διαθέσιμο για τη δέσμευση στη μεθαιμοσφαιρίνης.[23]
Οργανικά νιτρώδη
[Επεξεργασία | επεξεργασία κώδικα]
Στην οργανική χημεία, τα αλκυλονιτρώδη (alkyl nitrites) είναι εστέρες νιτρώδους οξέος και περιέχουν τη νιτροζοξυ χαρακτηριστική ομάδα. Οι νιτροενώσεις περιέχουν την ομάδα C–NO2. Τα νιτρώδη έχουν τον γενικό τύπο RONO, όπου το R είναι μια αρυλ ή αλκυλ ομάδα. Το νιτρώδες αμύλιο και άλλα αλκυλονιτρώδη έχουν αγγειοδιασταλτική δράση και πρέπει να χρησιμοποιούνται στο εργαστήριο με προσοχή. Μερικές φορές χρησιμοποιούνται στην ιατρική για τη θεραπεία καρδιακών παθήσεων. Μια κλασική επώνυμη αντίδραση (named reaction) για τη σύνθεση αλκυλονιτρωδών είναι η σύνθεση Meyer[24][25] στην οποία τα αλκυλαλογονίδια αντιδρούν με μεταλλικά νιτρώδη άλατα σε ένα μείγμα με νιτροαλκανίων και νιτρωδών.
Ασφάλεια
[Επεξεργασία | επεξεργασία κώδικα]Τα νιτρώδη άλατα μπορούν να αντιδράσουν με δευτερογενείς αμίνες για να παράγουν Ν-νιτροζαμίνες, για τις οποίες υπάρχει υποψία ότι προκαλούν καρκίνο του στομάχου. Ο Παγκόσμιος Οργανισμός Υγείας συμβουλεύει ότι κάθε 50 g (1,8 oz) επεξεργασμένου κρέατος που καταναλώνεται την ημέρα θα αύξανε τον κίνδυνο εμφάνισης καρκίνου του εντέρου κατά 18% σε σχέση στη διάρκεια της ζωής. Το επεξεργασμένο κρέας αναφέρεται στο κρέας που έχει μετατραπεί μέσω ζύμωσης, νιτρωδών συντήρησης, αλατίσματος, καπνίσματος ή άλλων διαδικασιών για την ενίσχυση της γεύσης ή τη βελτίωση της συντήρησης. Η ανασκόπηση του Παγκόσμιου Οργανισμού Υγείας για περισσότερες από 400 μελέτες κατέληξε στο συμπέρασμα, το 2015, ότι υπήρχαν επαρκή στοιχεία ότι τα επεξεργασμένα κρέατα προκαλούν καρκίνο, ιδιαίτερα καρκίνο του παχέος εντέρου. Ο Διεθνής Οργανισμός Ερευνών για τον Καρκίνο του ΠΟΥ (International Agency for Research on Cancer, IARC) ταξινόμησε τα επεξεργασμένα κρέατα ως καρκινογόνα για τον άνθρωπο (Κατάλογος καρκινογόνων ομάδας IARC 1).[10][26] Τα νιτρώδη (που λαμβάνονται) υπό συνθήκες που οδηγούν σε ενδογενή νιτροζυλίωση (nitrosation), συγκεκριμένα στην παραγωγή νιτροζαμίνης, έχει ταξινομηθεί ως Πιθανώς καρκινογόνα για τον άνθρωπο (Κατάλογος καρκινογόνων ομάδας 2A IARC (List of IARC Group 2A carcinogens)) από την IARC.[27][28]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 1,2 Laue, Wolfgang; Thiemann, Michael; Scheibler, Erich; Wiegand, Karl Wilhelm (2006). «Ullmann's Encyclopedia of Industrial Chemistry». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:. ISBN 978-3527306732.
- ↑ 2,0 2,1 2,2 2,3 Greenwood, pp. 461–464.
- ↑ IUPAC SC-Database Αρχειοθετήθηκε 19 June 2017 στο Wayback Machine. Μια περιεκτική βάση δεδομένων δημοσιευμένων δεδομένων σχετικά με τις σταθερές ισορροπίας μεταλλικών συμπλεγμάτων και προσδεμάτων
- ↑ Greenwood, p. 431.
- ↑ Ivanov, V. M. (2004-10-01). «The 125th Anniversary of the Griess Reagent» (στα αγγλικά). Journal of Analytical Chemistry 59 (10): 1002–1005. doi:. ISSN 1608-3199. https://doi.org/10.1023/B:JANC.0000043920.77446.d7.
- ↑ Sparacino-Watkins, Courtney; Stolz, John F.; Basu, Partha (2013-12-16). «Nitrate and periplasmic nitrate reductases» (στα αγγλικά). Chem. Soc. Rev. 43 (2): 676–706. doi:. ISSN 1460-4744. PMID 24141308.
- ↑ Simon, Jörg; Klotz, Martin G. (2013). «Diversity and evolution of bioenergetic systems involved in microbial nitrogen compound transformations» (στα αγγλικά). Biochimica et Biophysica Acta (BBA) - Bioenergetics 1827 (2): 114–135. doi:. PMID 22842521.
- ↑ «Effect of nitrite and nitrate on toxin production by Clostridium botulinum and on nitrosamine formation in perishable canned comminuted cured meat». Applied Microbiology 25 (3): 357–62. March 1973. doi:. PMID 4572891.
- ↑ Lee, Soomin; Lee, Heeyoung; Kim, Sejeong; Lee, Jeeyeon; Ha, Jimyeong; Choi, Yukyung; Oh, Hyemin; Choi, Kyoung-Hee και άλλοι. (August 2018). «Microbiological safety of processed meat products formulated with low nitrite concentration — A review». Asian-Australasian Journal of Animal Sciences 31 (8): 1073–1077. doi:. ISSN 1011-2367. PMID 29531192.
- ↑ 10,0 10,1 10,2 10,3 Wilson, Bee (2018-03-01). «Yes, bacon really is killing us» (στα αγγλικά). The Guardian (London). ISSN 0261-3077. Αρχειοθετήθηκε από το πρωτότυπο στις 2021-02-10. https://web.archive.org/web/20210210183650/https://www.theguardian.com/news/2018/mar/01/bacon-cancer-processed-meats-nitrates-nitrites-sausages. Ανακτήθηκε στις 2021-02-14. «In trade journals of the 1960s, the firms who sold nitrite powders to ham-makers spoke quite openly about how the main advantage was to increase profit margins by speeding up production.»
- ↑ Doward, Jamie (2019-03-23). «Revealed: no need to add cancer-risk nitrites to ham». The Observer (London). Αρχειοθετήθηκε από το πρωτότυπο στις 2021-01-26. https://web.archive.org/web/20210126134441/https://www.theguardian.com/food/2019/mar/23/nitrites-ham-bacon-cancer-risk-additives-meat-industry-confidential--report. Ανακτήθηκε στις 2021-02-14. «The results show that there is no change in levels of inoculated C. botulinum over the curing process, which implies that the action of nitrite during curing is not toxic to C. botulinum spores at levels of 150ppm [parts per million] ingoing nitrite and below.»
- ↑ De Vries, John (1997). Food Safety and Toxicity. CRC Press. σελ. 70. ISBN 978-0-8493-9488-1.
- ↑ sodium nitrite and nitrate facts Accessed 12 Dec 2014
- ↑ Doyle, Michael P.· Sperber, William H. (23 Σεπτεμβρίου 2009). Compendium of the Microbiological Spoilage of Foods and Beverages. Springer. σελ. 78. ISBN 9781441908261.
- ↑ Charles, R. L.; Rudyk, O.; Prysyazhna, O.; Kamynina, A.; Yang, J.; Morisseau, C.; Hammock, B. D.; Freeman, B. A. και άλλοι. (2014). «Protection from hypertension in mice by the Mediterranean diet is mediated by nitro fatty acid inhibition of soluble epoxide hydrolase». Proceedings of the National Academy of Sciences 111 (22): 8167–72. doi:. PMID 24843165. Bibcode: 2014PNAS..111.8167C.
- ↑ «Is celery juice a viable alternative to nitrites in cured meats?». Office for Science and Society (στα Αγγλικά). Ανακτήθηκε στις 14 Σεπτεμβρίου 2022.
- ↑ Bagheri, H.; Hajian, A.; Rezaei, M.; Shirzadmehr, A. (2017). «Composite of Cu metal nanoparticles—multiwall carbon nanotubes—reduced graphene oxide as a novel and high performance platform of the electrochemical sensor for simultaneous determination of nitrite and nitrate». Journal of Hazardous Materials 324 (Pt B): 762–772. doi:. PMID 27894754.
- ↑ Binkerd, E. F.; Kolari, O. E. (1975-01-01). «The history and use of nitrate and nitrite in the curing of meat». Food and Cosmetics Toxicology 13 (6): 655–661. doi:. ISSN 0015-6264. PMID 1107192.
- ↑ coudray, guillaume, eric (2017). Cochonneries : comment la charcuterie est devenue un poison. paris: Decouverte. σελίδες part I, chapter 2 (p. 40–55) and chapter 3 (p. 56–70). ISBN 9782707193582. OCLC 1011036745.
- ↑ Lauer, Klaus (1991-01-01). «The history of nitrite in human nutrition: A contribution from German cookery books» (στα αγγλικά). Journal of Clinical Epidemiology 44 (3): 261–264. doi:. ISSN 0895-4356. PMID 1999685. https://www.jclinepi.com/article/0895-4356(91)90037-A/abstract.
- ↑ «Guillaume Coudray on the Nitro Meat Cancer Connection». 14 Απριλίου 2021.
- ↑ Meillier, Andrew; Heller, Cara (2015). «Acute Cyanide Poisoning: Hydroxocobalamin and Sodium Thiosulfate Treatments with Two Outcomes following One Exposure Event». Case Reports in Medicine 2015: 217951. doi:. ISSN 1687-9627. PMID 26543483.
- ↑ Bebarta, Vikhyat S.; Brittain, Matthew; Chan, Adriano; Garrett, Norma; Yoon, David; Burney, Tanya; Mukai, David; Babin, Michael και άλλοι. (June 2017). «Sodium Nitrite and Sodium Thiosulfate Are Effective Against Acute Cyanide Poisoning when Administered by Intramuscular Injection». Annals of Emergency Medicine 69 (6): 718–725.e4. doi:. ISSN 0196-0644. PMID 28041825.
- ↑ Victor Meyer (1872). «Ueber die Nitroverbindungen der Fettreihe». Justus Liebig's Annalen der Chemie 171 (1): 1–56. doi:. https://zenodo.org/record/1427331.; Victor Meyer, J. Locher (1876). «Ueber die Pseudonitrole, die Isomeren der Nitrolsäuren». Justus Liebig's Annalen der Chemie 180 (1–2): 133–55. doi:. https://zenodo.org/record/1427351.; V. Meyer and Stüber (1872). «Vorläufige Mittheilung». Chemische Berichte 5: 203–05. doi:. https://zenodo.org/record/1425020.; Victor Meyer, O. Stüber (1872). «Ueber die Nitroverbindungen der Fettreihe». Chemische Berichte 5: 399–406. doi:. https://zenodo.org/record/1427331.; Victor Meyer, A. Rilliet (1872). «Ueber die Nitroverbindungen der Fettreiche. Dritte Mittheilung». Chemische Berichte 5 (2): 1029–34. doi:. https://zenodo.org/record/1425028.; Victor Meyer, C. Chojnacki (1872). «Ueber die Nitroverbindungen der Fettreihe. Vierte Mittheilung». Chemische Berichte 5 (2): 1034–38. doi:. https://zenodo.org/record/1425030.
- ↑ Robert B. Reynolds, Homer Adkins (1929). «The Relationship of the Constitution of Certain Alky Halides to the Formation of Nitroparaffins and Alkyl Nitrites». Journal of the American Chemical Society 51 (1): 279–87. doi:.
- ↑ «IARC Monographs evaluate consumption of red meat and processed meat» (PDF). International Agency for Research on Cancer. 26 Οκτωβρίου 2015. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 18 Ιανουαρίου 2021. Ανακτήθηκε στις 14 Φεβρουαρίου 2021.
Processed meat was classified as carcinogenic to humans (Group 1), based on sufficient evidence in humans that the consumption of processed meat causes colorectal cancer.
- ↑ «List of classifications, Volumes 1–116 – IARC Monographs on the Evaluation of Carcinogenic Risks to Humans». International Agency for Research on Cancer (IARC) – World Health Organization (WHO). 2010. Αρχειοθετήθηκε από το πρωτότυπο στις 10 Ιουνίου 2017. Ανακτήθηκε στις 25 Σεπτεμβρίου 2016.
- ↑ VOLUME 94 – Ingested Nitrate and Nitrite, and Cyanobacterial Peptide Toxins – IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. International Agency for Research on Cancer (IARC) – World Health Organization (WHO). 2010. ISBN 9789283212942. Ανακτήθηκε στις 25 Σεπτεμβρίου 2016.
Βιβλιογραφία
[Επεξεργασία | επεξεργασία κώδικα]- Coudray, Guillaume, Who poisoned your bacon. London: Icon Books, 2021. (ISBN 9-781-78578612-9)



