Σιδηρικυανιούχο ιόν
| Σιδηρικυανιούχο | |
|---|---|
| |

| |
| Γενικά | |
| Όνομα IUPAC | Εξακυανοσιδηρικό(ΙΙΙ) |
| Χημικά αναγνωριστικά | |
| Μοριακή μάζα | 211,9494 (g/mol) |
| SMILES | [C-]#N.[C-]#N.[C-]#N.[C-]#N.[C-]#N.[C-]#N.[Fe+3] |
| PubChem CID | 439210 |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
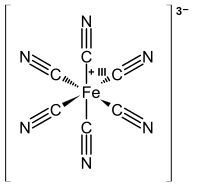
Σιδηρικυανιούχο ή εξακυανοσιδηρικό(ΙΙΙ) είναι το όνομα του συμπλόκου ανιόντος [Fe(CN)]63–. Η συνηθέστερη μορφή του σε υδατικό διάλυμα είναι του άλατος με κάλιο, του σιδηρικυανιούχου καλίου, K3Fe(CN)6.
Δομή - φυσικά χαρακτηριστικά
[Επεξεργασία | επεξεργασία κώδικα]Το σιδηρικυανιούχο ιόν είναι παραμαγνητικό επειδή διαθέτει μονήρες ηλεκτρόνιο. Το άτομο του σιδήρου έχει αριθμό οξείδωσης +3.[1]
Το κεντρικό ιόν σιδήρου έχει αριθμό συναρμογής 6,το σύμπλοκο είναι οκταεδρικό και ανήκει στην ομάδα[Σημ. 1] υψηλής συμμετρίας Oh αφού παρουσιάζει 48 στοιχεία συμμετρίας[2] : Ταυτότητα (Ε), άξονες συμμετρίας 6C4, 8C3, 6C2', 3C2 (=3C42), κέντρο συμμετρίας (i), άξονες στροφοκατοπτρισμού 6S4, 8S6, 3 κατακόρυφα επίπεδα συμμετρίας σh και 3 διαγώνια σd.
Το ιόν απορροφά σε διάλυμα στα 35000 cm−1. Από τη μελέτη του φάσματος σε διάλυμα, διαπιστώθηκε επίσης ότι ο τριπλός δεσμός C≡N απορροφά στα 2118 cm−1[Σημ. 2] και ο δεσμός Fe-C στα 389 cm−1[3].
Χημικά χαρακτηριστικά
[Επεξεργασία | επεξεργασία κώδικα]Το ιόν εμφανίζεται όταν διαλυθεί σύμπλοκο που το περιέχει. Αν δηλαδή διαλυθεί στο νερό το Κ3[Fe(CN)6] δεν προκύπτουν ιόντα Fe3+ αλλά λαμβάνει χώρα η ισορροπία[4] :
- Κ3[Fe(CN)6] 3K+ + [Fe(CN)6]3–
Το σιδηρικυανιούχο ιόν είναι κάπως πιο δραστικό από το σιδηροκυανιούχο παρά το γεγονός ότι είναι θερμοδυναμικά σταθερότερο όσον αφορά το διαχωρισμό στα συστατικά ιόντα τους. Τα κεντρικά άτομα Fe2+ (στο σιδηροκυανιούχο) και Fe3+ (στο σιδηρικυανιούχο) έχουν ιονικές ακτίνες αντίστοιχα 0,76 Å[Σημ. 3] και 0,64 Å. Επομένως η πυκνότητα φορτίου είναι πολύ μεγαλύτερη στο ιόν Fe3+, αφού αυτό έχει μικρότερη ιονική ακτίνα, οπότε αυτό εξασκεί μεγαλύτερες έλξεις στους υποκαταστάτες και συνεπώς το σύμπλοκο [Fe(CN)6]3– είναι σταθερότερο του [Fe(CN)6]4–[1][Σημ. 4].
Πάντως το [Fe(CN)6]3– είναι λιγότερο σταθερό από άλλες ενώσεις του Fe3+. Αναφέρεται[5] η σειρά σταθερότητας μερικών ενώσεων του Fe3+ :
- [Fe(CN)6]3– < Fe(C2O4)2– < Fe(PO4)23– < FeF63– < Fe(SCN)63– < FeCl63–
Χημικές αντιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδατικού διαλύματος αμμωνίας στο [Fe(CN)6]3-, σχηματίζεται καστανόχρωμο ζελατινώδες ίζημα υδροξειδίου του σιδήρου(ΙΙΙ)[5] :
- [Fe(CN)6]3– + 3NH3 + 3H2Ο Fe(OH)3 + 3NH4CN + 3CN–
Το ίδιο ίζημα σχηματίζεται και από την επίδραση υδροξυλιόντων (π.χ. υδροξειδίου του νατρίου)[5] :
- [Fe(CN)6]3– + 3OH– Fe(OH)3 + 6CN–
Η παραπάνω ισορροπία είναι σαφώς μετατοπισμένη προς τα αριστερά[3] αφού έχει σταθερά ισορροπίας Κ = 10−5.
Σε αλκαλικό περιβάλλον, η επίδραση ιόντων θείου, S2–, οδηγεί στο σχηματισμό μαύρου ιζήματος θειούχου σιδήρου(ΙΙΙ)[5] :
- 2[Fe(CN)6]3– + 3S2– Fe2S3 + 12CN–
Το σύστημα σιδηρικυανιούχα-σιδηροκυανιούχα
[Επεξεργασία | επεξεργασία κώδικα]Η σημαντικότερη αντίδραση των σιδηρικυανιούχων είναι η αναγωγή τους προς σιδηροκυανιούχα και η αποκατάσταση της ισορροπίας :
- [Fe(CN)6]3– + e– [Fe(CN)6]4–
Οι παρατηρούμενες τιμές του δυναμικού οξειδοαναγωγής ενός διαλύματος που περιέχει ίσες συγκεντρώσεις [Fe(CN)6]3– και [Fe(CN)6]4–, ποικίλουν ανάλογα με τη συγκέντρωση και την (πιθανή) παρουσία κατιόντων. Ορισμένες τυπικές τιμές, χωρίς την προσθήκη ηλεκτρολυτών, δίνονται στον πίνακα που ακολουθεί[3] :
| Συγκέντρωση (Μ) | 0,1 |
0,01 |
0,001 |
0,0001
|
| Ε (Volt) | +0,459 | +0,415 | +0,383 | +0,366 |
Από τις παραπάνω αλλά και άλλες τιμές προκύπτει το κανονικό δυναμικό οξειδοαναγωγής Ε0 = +0,356 Volt, σε μηδενική ιονική ισχύ.
Τα ισχυρά οξέα αυξάνουν το δυναμικό περισσότερο από ουδέτερα άλατα της ίδιας ιονικής ισχύος. Για παράδειγμα, παρουσία θειικού οξέος, H2SO4 και για συγκέντρωση 0,5 Μ, το Ε0 γίνεται +0,69 Volt ενώ για συγκέντρωση 1 Μ γίνεται +0,72 Volt. Αντίθετα, τα υδροξυλιόντα επηρεάζουν λίγο το δυναμικό. Η παρουσία αλκαλιμετάλλων αυξάνει ελαφρά το δυναμικό από το καίσιο προς το λίθιο.
Η διαφορά μεταξύ των Ε0 των συστημάτων Fe3+/Fe2+ και [Fe(CN)6]3–/[Fe(CN)6]4– προϋποθέτει ότι το σιδηρικυανιούχο είναι σταθερότερο του σιδηροκυανιούχου, όσον αφορά την (υποθετική) αποσύνθεσή τους στα συστατικά τους στοιχεία, κατά έναν παράγοντα 107.
Ούτε το σύμπλοκο [Fe(CN)6]4– ούτε το [Fe(CN)6]3– διασπώνται-αποσυντίθενται στα στοιχεία[3] τους σε διάλυμα αφού η σταθερά διάσπασης του πρώτου είναι K = 10−35 και του δεύτερου K = 10−42.
Σχηματισμός - κατάταξη του συμπλόκου
[Επεξεργασία | επεξεργασία κώδικα]
Σύμφωνα με τη θεωρία δεσμού-σθένους (Valence-Bond Theory, VBT) του Πόλινγκ (Linus Pauling)[Σημ. 5] τα πέντε μονήρη ηλεκτρόνια που υπάρχουν στα 3d ατομικά τροχιακά του Fe3+ αναγκάζονται υπό την επίδραση των κυανιούχων, CN–, να συμπτυχθούν σε τρία 3d τροχιακά, οπότε τα δύο πλέον κενά 3d μαζί με τo 4s και τα 4p ατομικά τροχιακά (που ούτως ή άλλως υπάρχουν αλλά χωρίς ηλεκτρόνια) υβριδοποιούνται δίνοντας έξι d2sp3 υβριδισμένα τροχιακά οκταεδρικής συμμετρίας. Τα υβριδισμένα αυτά τροχιακά του Fe3+ διατίθενται για τη δημιουργία δεσμών συναρμογής –NC→Fe3+[6].
Τo σιδηρικυανιούχο ιόν κατατάσσεται στα σύμπλοκα ισχυρού κρυσταλλικού πεδίου, συζευγμένου ή χαμηλού spin[Σημ. 6], αφού οι υποκαταστάτες, δηλαδή τα CN–, σχηματίζουν δεσμούς συναρμογής με τα d τροχιακά της προτελευταίας στιβάδας του κεντρικού ιόντος Fe3+[1].
Τοξικότητα
[Επεξεργασία | επεξεργασία κώδικα]Το σιδηρικυανιούχο ιόν δεν είναι κινητικά αδρανές, αποδίδει εύκολα τα κυανιούχα ιόντα του σε άλλες ουσίες και συνεπώς είναι πολύ τοξικό[7].
Χρήσεις
[Επεξεργασία | επεξεργασία κώδικα]Το ιόν χρησιμοποιείται με τη μορφή των αλάτων του όπως ο σιδηρικυανιούχος σίδηρος κυρίως ως μπλε χρωστική στη ζωγραφική και σε κυανοτυπίες.
Σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Η συμμετρία που εμφανίζεται στα άτομα και μόρια είναι γνωστή ως μοριακή συμμετρία και η μελέτη της γίνεται με μια τεχνική των μαθηματικών που είναι γνωστή ως θεωρία των ομάδων
- ↑ Συχνά στα ηλεκτρονικά φάσματα αντί της συχνότητας f ή του μήκους κύματος λ χρησιμοποιείται ο κυματάριθμος που είναι το αντίστροφο του μήκους κύματος
- ↑ 1 Å = 1×10–10 m
- ↑ Υπάρχει ο εμπειρικός κανόνας που λέει ότι τα ιόντα με μεγαλύτερη πυκνότητα φορτίου σχηματίζουν σταθερότερα σύμπλοκα με την προϋπόθεση βέβαια τα ligands να είναι ίδια ή παρόμοια.
- ↑ Linus Carl Pauling (1901 – 1994). Αμερικανός χημικός από τους διασημότερους του 20ου αιώνα. Βραβεία Nobel Χημείας 1954 και Ειρήνης 1962
- ↑ Παλιότερα ονομάζονταν σύμπλοκα εσωτερικών τροχιακών
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 1,2 Τοσσίδης, Ιωάννης Α. (2001). Χημεία ενώσεων συναρμογής. Ζήτη. ISBN 9604317547.
- ↑ Τσίπης Κ. (1996). Εισαγωγή στην Κβαντική Χημεία, Μοριακή Δομή, τόμος 2. Γ. Δεδούσης. ISBN 960-431-554-4.
- ↑ 3,0 3,1 3,2 3,3 H.J. Emeleus and A.G. Sharpe, επιμ. (1966). Advances in Inorganic Chemistry and Radiochemistry. Elsevier B.V. ISBN 9780120236084.
- ↑ De, Anil Kumar (2003). A Textbook of Inorganic Chemistry (9η έκδοση). New Age International. ISBN 978-81-224-1384-7.
- ↑ 5,0 5,1 5,2 5,3 Βασιλικιώτης Γ.Σ. (1976). Αναλυτική χημεία. Ποιοτική ανάλυσις. Τεύχος πρώτον (2η έκδοση).
- ↑ Darrell D. Ebbing,Steven D. Gammon (2008). Cengage Learning, επιμ. General Chemistry (9η έκδοση). ISBN 0618857486.
- ↑ Μανουσάκης, Γεώργιος Ε. (1992). Γενική χημεία βιολογικών επιστημών. Κυριακίδη Αφοί. ISBN 960-343-174-5.
Επιλεγμένη βιβλιογραφία
[Επεξεργασία | επεξεργασία κώδικα]- Ebbing D.D, Gammon S.D. (2008). General Chemistry (9η έκδοση). Cengage Learning. ISBN 0618857486.
- Emeleus H. J., Sharpe A. G. (1966). Advances in Inorganic Chemistry. Academic Press. ISBN 9780120236084.
- Mackay K.M.· Mackay R.A.· Henderson W. (2002). Introduction to modern inorganic chemistry (1η έκδοση). CRC Press. ISBN 0748764208.
- Μανουσάκης Γ.Ε. (1994). Γενική και Ανόργανη Χημεία. Αφοι Κυριακίδη, Θεσσαλονίκη. ISBN 9603432725.
- Pauling L. (2003). General Chemistry (3η έκδοση). Dover Publications Inc. ISBN 9780486656229.
- Τοσσίδης Ι. (2001). Χημεία Ενώσεων Συναρμογής. Εκδόσεις Ζήτη, Θεσσαλονίκη. ISBN 9789604317547.
- Wiberg E.· Nils Wiberg N.· Holleman A.F. (2001). Inorganic chemistry. Academic Press. ISBN 0123526515.

