Τριχλωριούχο αμερίκιο
| Τριχλωριούχο Αμερίκιο | |
|---|---|
| |
| Γενικά | |
| Όνομα IUPAC | Χλωριούχο(III) Αμερίκιο |
| Άλλες ονομασίες | Χλωριούχο Αμερίκιο
Τριχλωριούχο Αμερίκιο |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | AmCl3 |
| Μοριακή μάζα | 349.42 g mol-1 |
| Αριθμός CAS | 13464-46-5 |
| SMILES | [Cl-].[Cl-].[Cl-].[Am+3] |
| InChI | InChI=1S/Am.3ClH/h;3*1H/q+3;;;/p-3
Key: GQKWPBIZTINWCF-UHFFFAOYSA-K |
| ChemSpider ID | 15964177 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 715 °C, 988 K, 1319 °F ([1]) |
| Σημείο βρασμού | 850 °C, 1123 K, 1562 °F ([2] |
| Πυκνότητα | 5.87 g cm-3 [2] |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
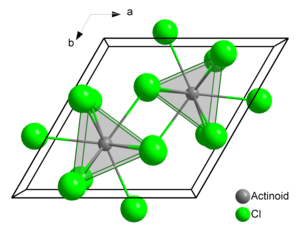
Το Τριχλωριούχο Αμερίκιο είναι η χημική ένωση με τον τύπο AmCl3. Σχηματίζει ροζ εξαγωνικούς κρυστάλλους. Στην στερεή φάση κάθε άτομο αμερικίου έχει 9 άτομα χλωρίου σαν κοντινούς γείτονες σε περίπου την ίδια απόσταση, σε μια τρισφραγισμένη τριγωνικη πρισματική διαμόρφωση[3][4].
Ο εξαϋδρίτης έχει μονοκλινική κρυσταλλική δομή με: a = 970,2 pm, b = 656,7 pm and c = 800,9 pm; β = 93° 37'· ομάδα χώρου: P2/n[5].
Αντιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Μία ηλεκτρολυτική μέθοδος από το Τριχλωριούχο Αμερίκιο έχει ερευνηθεί σε χωριστά μείγματα από λανθανίδες, δεδομένου ότι το πρότυπο «ελεύθερη ενέργεια Gibbs σχηματισμού τριχλωριούχου αμερικίου» είναι πολύ διαφορετική από τα υπόλοιπα χλωρίδια των λανθανιδών[6]. Αυτό μπορεί να χρησιμοποιηθεί για την αφαίρεση του αμερικίου από το πλουτώνιο με τήξη του ακατέργαστου μείγματος μαζί με άλατα όπως χλωριούχο νάτριο.[7]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Perry, Dale L.; Phillips, Sidney L. (1995), Handbook of Inorganic Compounds, CRC Press, σελ. 15, ISBN 0-8493-8671-3, http://books.google.com/?id=0fT4wfhF1AsC&pg=PA15, ανακτήθηκε στις 2008-06-25
- ↑ 2,0 2,1 «Chemistry: Periodic Table: americium: compound data (americium (III) chloride)». WebElements. Ανακτήθηκε στις 24 Ιουνίου 2008.
- ↑ L. B. Asprey, T. K. Keenan, F. H. Kruse: "Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium", Inorg. Chem. 1965, 4 (7), 985–986; .
- ↑ A. F. Wells: Structural Inorganic Chemistry 5th edition (1984) Oxford Science Publications, ISBN 0-19-855370-6.
- ↑ John H. Burns, Joseph Richard Peterson: "The Crystal Structures of Americium Trichloride Hexahydrate and Berkelium Trichloride Hexahydrate", Inorg. Chem. 1971, 10 (1), 147–151; .
- ↑ Nuclear Energy Agency (2001), written at Avignon, France, Proceedings of the Workshop on Pyrochemical Separations, OECD Publishing, σελ. 276–277, ISBN 92-64-18443-0, http://books.google.com/?id=Gv7ohTjfG0UC&pg=PA277&dq=%22Americium+chloride%22, ανακτήθηκε στις 2008-06-24
- ↑ Plutonium Processing In The Nuclear Weapons Complex, Diane Publishing, σελ. 21, ISBN 1-56806-568-X, http://books.google.com/?id=0fc3lpCtUM4C&pg=PA21&dq=%22Americium+chloride%22, ανακτήθηκε στις 2008-06-24
