1-ιωδο-2-φθοροκυκλοπροπάνιο
Εμφάνιση
| 1-ιωδο-2-φθοροκυκλοπροπάνιο | |
|---|---|
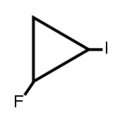 | |
| Συστηματικό όνομα | 1-ιωδο-2-φθοροκυκλοπροπάνιο |
| SMILES | C1(I)CC(F)1 |
| Χημικός τύπος | C3H4FI |
| Εμφάνιση: | |
| Μοριακή μάζα | 185,968 amu |
| Σημείο τήξης (1 atm) | |
| Σημείο βρασμού (1 atm) | |
Το 1-ιωδο-2-φθοροκυκλοπροπάνιο ή 2-φθοροκυκλοπροπυλοϊωδίδιο είναι μια οργανική ένωση της ομόλογης σειράς των διαλογονοκυκλοαλκανίων. Θεωρητικά προκύπτει από το κυκλοπροπάνιο, αν αντικατασταθούν δύο (2) άτομα υδρογόνου από ένα άτομο ιωδίου και ένα φθορίου. Έτσι προκύπτει ο χημικός του τύπος: C3H4FΙ στη θέση αυτού του κυκλοπροπανίου (C3H6). Με βάση το χημικό του τύπο η ένωση έχει τα ακόλουθα (9) ισομερή θέσης:
- 1-ιωδο-1-φθοροκυκλοπροπάνιο.
- 1-ιωδο-1-φθοροπροπένιο.
- 1-ιωδο-2-φθοροπροπένιο.
- 1-ιωδο-3-φθοροπροπένιο.
- 2-ιωδο-1-φθοροπροπένιο.
- 2-ιωδο-3-φθοροπροπένιο.
- 3-ιωδο-1-φθοροπροπένιο.
- 3-ιωδο-2-φθοροπροπένιο.
- 3-ιωδο-3-φθοροπροπένιο.
Ακόμη, το 1-ιωδο-2-φθοροκυκλοπροπάνιο και δυο γεωμετρικά Ε-, Ζ- ή cis-, trans-.
Μοριακή δομή
[Επεξεργασία | επεξεργασία κώδικα]| Δεσμοί | ||||
| Δεσμός | τύπος δεσμού | ηλετρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp2-1s | pm | 3% C- H+ |
| C-Ι | σ | 2sp2-5sp3 | 210 pm | 5‰ C+ Ι- |
| C-F | σ | 2sp2-2sp3 | 138 pm | 43% C+ F- |
| C-C[1] | 151 pm | |||
- Οι γωνίες του ισοσκελούς τριγώνου του δακτυλίου είναι από 60ο.
- Οι γωνίες H-C-H, H-C-F και H-C-I είναι από 120ο, κάθετα στο επίπεδο που ορίζει το τρίγωνο του δακτυλίου.
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση Hg2F2 σε 1,2-διιωδοκυκλοπροπάνιο:
- Συμπαράγεται 1,2-διφθοροκυκλοπροπάνιο.
- Η σντίδραση πραγματοποιείται ουσιαστικά χάρη της διαφοράς διαλυτότητας Hg2F2 και Hg2I2: Το Hg2I2 είναι δυσδιάλυτο και έτσι απομακρύνει I- από την χημική ισορροπία και αυτό λειτουργεί υπέρ της παραγωγής του φθοροπαραγώγου.
Χημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]- Το Ι και υποκαθιστά και αποκαθίσταται πολύ ευκολότερα από το F. Γι' αυτό στις παρακάτω αντιδράσεις είναι ευκολότερο να ληφθούν σχετικά μεγάλες αποδόσεις σε προϊόντα υποκατάστασης μόνο του ιωδίου. Επίσης η παρουσία του τριμελούς δακτυλίου επιτρέπει μεγάλο αριθμό αντιδράσεων προσθήκοδιάσπασης-1,3.:
Παραπομπές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Δείτε το κυκλοπροπάνιο για ανάλυση της δομής του τριμελούς δακτυλίου.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982


