2-προπεν-1-αμίνη
| 2-προπεν-1-αμίνη | |
|---|---|

| |
| Γενικά | |
| Όνομα IUPAC | 2-προπεν-1-αμίνη |
| Άλλες ονομασίες | Αλλυλαμίνη 1-αμινοπροπένιο-2 1-αζαβουτένιο-3 |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C3H7N |
| Μοριακή μάζα | 43,0678 amu |
| Σύντομος συντακτικός τύπος |
CH2=CHCH2NH2 |
| Συντομογραφίες | AllNH2, MAA |
| Αριθμός CAS | 107-11-9 |
| SMILES | C=CCN |
| InChI | InChI=1/C3H7N/c1-2-3-4/h2H,1,3-4H2 |
| Αριθμός RTECS | BA5425000 |
| PubChem CID | 7565 |
| Ισομέρεια | |
| Ισομερή θέσης | 11 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | -88°C |
| Σημείο βρασμού | 55-58°C |
| Πυκνότητα | 763 kg/m3 |
| Χημικές ιδιότητες | |
| Ελάχιστη θερμοκρασία ανάφλεξης |
-28°C |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Η προπεν-1-αμίνη-2 ή 1-αμινοπροπένιο-2 ή αλλυλαμίνη-1 ή 1-αζαβουτένιο-3 είναι η χημική ένωση με σύντομο συντακτικό τύπο CH2=CHCH2NH2. Είναι η απλούστερη σταθερή αλκεναμίνη (ή και γενικότερα εναμίνη), δηλαδή άκυκλη μονοαμίνη με ένα διπλό δεσμό. Με βάση το χημικό τύπο της, C3H7N, έχει τα ακόλουθα ένδεκα (11) ισομερή θέσης:
- Προπεν-1-αμίνη-1 με σύντομο συντακτικό τύπο: CH3CH=CHNH2 (σε δύο (2) γεωμετρικά ισομερή).
- Προπεναμίνη-2 με σύντομο συντακτικό τύπο: CH3C(NH2)=CH2.
- N-μεθυλαιθεναμίνη ή βινυλομεθυλαμίνη με σύντομο συντακτικό τύπο: CH3NHCH=CH2.
- Προπανιμίνη-1 με σύντομο συντακτικό τύπο: CH3CH2CH=NH.
- Προπανιμίνη-2 με σύντομο συντακτικό τύπο: CH3C(=NH)CH3.
- N-μεθυλαιθανιμίνη με σύντομο συντακτικό τύπο: CH3N=CHCH3.
- Ν-αιθυλομεθανιμίνη με σύντομο συντακτικό τύπο: CH2=NCH2CH3.
- Κυκλοπροπαναμίνη με σύντομο συντακτικό τύπο:
 .
. - Αζετιδίνη ή επαζωπροπάνιο-1,3 με σύντομο συντακτικό τύπο
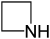 .
. - 2-μεθυλαζιριδίνη ή επαζωπροπάνιο-1,2 με σύντομο συντακτικό τύπο
 .
. - N-μεθυλαζιριδίνη ή Ν-μεθυλεπαζαιθάνιο με σύντομο συντακτικό τύπο
 .
.
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Με αμμωνία και αλλυλαλογονίδιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση αμμωνίας (NH3) σε αλλυλαλογονίδιο (μέθοδος Hofmann) παράγεται προπεν-2-αμίνη-1[1]:
- Συμπαράγονται διαλλυλαμίνη και τριαλλυλαμίνη. Η χημική κινητική καθορίζει την τελική αναλογία αυτών των προϊόντων.
Με αποικοδόμηση βουτεν-3-αμιδίου
[Επεξεργασία | επεξεργασία κώδικα]Με αποικοδόμηση βουτεν-3-αμιδίου (CH2=CHCH2CONH2, μετάθεση Hofmann) παράγεται προπεν-2-αμίνη-1[2]:
- Το BrOK παράγεται επιτόπου («in citu») με την αντίδραση:
Με χλωραμίνη σε αλλυλομαγνησιοαλογονίδιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση χλωραμίνης (NH2Cl) σε αλλυλομαγνησιοαλογονίδιο (CH2=CHCH2MgX) παράγεται προπεν-2-αμίνη-1[3]:
Με αφυδάτωση 3-αμινοπροπανόλης-1
[Επεξεργασία | επεξεργασία κώδικα]Με ενδομοριακή αφυδάτωση 3-αμινοπροπανόλης-1 παράγεται προπεν-2-αμίνη-1. Η αντίδραση ευνοείται σε σχετικά υψηηλές θερμοκρασίες, >150 °C[4]:
Με απόσπαση υδραλογόνου
[Επεξεργασία | επεξεργασία κώδικα]Με απόσπαση υδραλογόνου (HX) από 3-αλοπροπαναμίνη-1 παράγεται προπεν-2-αμίνη-1[5]:
Με απόσπαση αλογόνου
[Επεξεργασία | επεξεργασία κώδικα]Με απόσπαση αλογόνου (X2) από 2,3-διαλοπροπαναμίνη-1 παράγεται προπεν-2-αμίνη-1[6]:
Με μερική καταλυτική υδρογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Με μερική καταλυτική υδρογόνωση προπιν-2-αμίνης-1 παράγεται προπεν-2-αμίνη-1[7]
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Συμπεριφορά βάσης
[Επεξεργασία | επεξεργασία κώδικα]
- Η αλλυλική θέση του δεσμού της εξασθενεί τη βασική της συμπεριφορά.
- Περίσσεια υδροχλωρικού οξέος δίνει υδροχλωρική 2-χλωροπροπαναμίνη-1:
Αλκυλίωση
[Επεξεργασία | επεξεργασία κώδικα]Παράγει δευτεροταγείς αλλυλαμίνες με αλκυλαλογονίδια (RX). Π.χ.:
Ακυλίωση
[Επεξεργασία | επεξεργασία κώδικα]Παράγει δευτεροταγή αμίδια με ακυλαλογονίδια (RCOX). Π.χ.:
Ιμίνες
[Επεξεργασία | επεξεργασία κώδικα]Με καρβονυλικές ενώσεις δείνει ιμίνες. Π.χ. με αλδεΰδες (RCHO) δίνει:
Οξείδωση
[Επεξεργασία | επεξεργασία κώδικα]Οξειδώνεται προς 3-νιτροπροπένιο:
Παρατηρήσεις, υποσημειώσεις και αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2B3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.243, §10.2Γ3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.158, §6.9.4.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, Οργανική Χημεία, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα] Πολυμέσα σχετικά με το θέμα Allylamine στο Wikimedia Commons
Πολυμέσα σχετικά με το θέμα Allylamine στο Wikimedia Commons





![{\displaystyle \mathrm {H_{2}NCH_{2}CH_{2}CH_{2}OH{\xrightarrow[{>150^{o}C}]{\pi .H_{2}SO_{4}}}CH_{2}=CHCH_{2}NH_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/25545f2d487cff6433f171d7acaf3dd8b0bb5844)
![{\displaystyle \mathrm {XCH_{2}CH_{2}CH_{2}NH_{2}+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{2}=CHCH_{2}NH_{2}+NaX+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/94922773d94529ea3b4ab76b958af9d134716585)







