Μείωση (βιολογία)

Η μείωση (Meiosis) (αφού είναι μειωτική διαίρεση))[1][2] είναι ένας ειδικός τύπος κυτταρικής διαίρεσης των γεννητικών κυττάρων σε φυλετικά αναπαραγόμενους οργανισμούς που παράγει τους γαμέτες, το σπερματοζωάριο ή ωάρια. Περιλαμβάνει δύο κύκλους διαίρεσης που τελικά καταλήγουν σε τέσσερα κύτταρα, το καθένα με μόνο ένα αντίγραφο από κάθε (απλοειδές) χρωμόσωμα. Επιπλέον, πριν από τη διαίρεση, το γενετικό υλικό από τα πατρικά και μητρικά αντίγραφα κάθε χρωμοσώματος επιχιάζεται, δημιουργώντας νέους συνδυασμούς κώδικα σε κάθε χρωμόσωμα.[3] Αργότερα, κατά τη γονιμοποίηση, τα απλοειδή κύτταρα που παράγονται από τη μείωση από ένα αρσενικό και ένα θηλυκό θα συγχωνευτούν για να δημιουργήσουν έναν ζυγώτη, ένα κύτταρο με δύο αντίγραφα από κάθε χρωμόσωμα ξανά. Τα σφάλματα στη μείωση που οδηγούν σε ανευπλοειδία (ανώμαλος αριθμός χρωμοσωμάτων) είναι η κύρια γνωστή αιτία αποβολής και η πιο συχνή γενετική αιτία αναπτυξιακών αναπηριών.[4] Στη μείωση, η αντιγραφή του DNA ακολουθείται από δύο κύκλους κυτταρικής διαίρεσης για την παραγωγή τεσσάρων θυγατρικών κυττάρων, το καθένα με το ήμισυ του αριθμού των χρωμοσωμάτων ως το αρχικό γονικό κύτταρο.[3] Οι δύο μειωτικές διαιρέσεις είναι γνωστές ως μείωση Ι και μείωση ΙΙ. Πριν ξεκινήσει η μείωση, κατά της φάσης S (φάση σύνθεσης) του κυτταρικού κύκλου, το DNA κάθε χρωμοσώματος αντιγράφεται έτσι ώστε να αποτελείται από δύο ταυτόσημες αδελφές χρωματίδες, οι οποίες παραμένουν συγκρατημένες μεταξύ τους μέσω της συνοχής των αδελφών χρωματιδίων. Αυτή η φάση S μπορεί να αναφέρεται ως προμειωτική φάση S ή μειωτική φάση S. Αμέσως μετά την αντιγραφή του DNA, τα μειωτικά κύτταρα εισέρχονται σε ένα παρατεταμένο στάδιο που μοιάζει με τη φάση G2 (φάση ανάπτυξης), γνωστό ως μειωτική πρόφαση. Κατά τη διάρκεια αυτής της περιόδου, τα ομόλογα χρωμοσώματα ζευγαρώνουν μεταξύ τους και υφίστανται γενετικό ανασυνδυασμό, μια προγραμματισμένη διαδικασία κατά την οποία το DNA μπορεί να κοπεί και στη συνέχεια να επισκευαστεί, κάτι που τους επιτρέπει να ανταλλάξουν μερικές από τις γενετικές πληροφορίες τους. Ένα υποσύνολο συμβάντων ανασυνδυασμού έχει ως αποτέλεσμα επιχιασμούς, που δημιουργούν φυσικούς δεσμούς γνωστούς ως χιάσματα μεταξύ των ομόλογων χρωμοσωμάτων. Στους περισσότερους οργανισμούς, αυτοί οι σύνδεσμοι μπορούν να βοηθήσουν ώστε να κατευθύνουν κάθε ζεύγος ομόλογων χρωμοσωμάτων να διαχωριστεί μακριά το ένα από το άλλο κατά τη διάρκεια της μείωσης Ι, με αποτέλεσμα δύο απλοειδή κύτταρα που έχουν τον μισό αριθμό χρωμοσωμάτων από το γονικό κύτταρο. Κατά τη διάρκεια της μείωσης ΙΙ, η συνοχή μεταξύ των αδελφών χρωματίδων απελευθερώνεται και διαχωρίζονται η μία από την άλλη, όπως κατά τη μίτωση. Σε ορισμένες περιπτώσεις, και τα τέσσερα μειωτικά προϊόντα σχηματίζουν γαμέτες όπως σπέρμα, σπόρια ή γύρη. Στα θηλυκά ζώα, τρία από τα τέσσερα μειωτικά προϊόντα τυπικά εξαλείφονται με εξώθηση σε πολικά σωμάτια και μόνο ένα κύτταρο αναπτύσσεται για να παράγει ένα ωάριο. Επειδή ο αριθμός των χρωμοσωμάτων μειώνεται στο μισό κατά τη διάρκεια της μείωσης, οι γαμέτες μπορούν να συντηχθούν (δηλαδή γονιμοποίηση) για να σχηματίσουν ένα διπλοειδές ζυγωτό που περιέχει δύο αντίγραφα κάθε χρωμοσώματος, ένα από κάθε γονέα. Έτσι, οι εναλλασσόμενοι κύκλοι μείωσης και γονιμοποίησης επιτρέπουν τη εγγενή αναπαραγωγή, με τις διαδοχικές γενιές να διατηρούν τον ίδιο αριθμό χρωμοσωμάτων. Για παράδειγμα, τα διπλοειδή ανθρώπινα κύτταρα περιέχουν 23 ζεύγη χρωμοσωμάτων, συμπεριλαμβανομένων 1 ζεύγους φυλετικών χρωμοσωμάτων (46 συνολικά), τα μισά μητρικής προέλευσης και τα μισά πατρικής προέλευσης. Η μείωση παράγει απλοειδείς γαμέτες (ωάρια ή σπέρμα) που περιέχουν ένα σύνολο 23 χρωμοσωμάτων. Όταν δύο γαμέτες (ένα ωάριο και ένα σπέρμα) συντηχθούν, το ζυγωτό που προκύπτει είναι και πάλι διπλοειδές, με τη μητέρα και τον πατέρα να συνεισφέρουν ο καθένας από 23 χρωμοσώματα. Αυτό το ίδιο μοτίβο, αλλά όχι ο ίδιος αριθμός χρωμοσωμάτων, εμφανίζεται σε όλους τους οργανισμούς που χρησιμοποιούν τη μείωση. Η μείωση εμφανίζεται σε όλους τους φυλετικά αναπαραγόμενους μονοκύτταρους και πολυκύτταρους οργανισμούς (που είναι όλοι ευκαρυώτες), συμπεριλαμβανομένων των ζώων, των φυτών και των μυκήτων.[5][6][7] Είναι μια απαραίτητη διαδικασία για ωογένεση και σπερματογένεση.
Επισκόπηση
[Επεξεργασία | επεξεργασία κώδικα]Αν και η διαδικασία της μείωσης σχετίζεται με τη γενικότερη διαδικασία της κυτταρικής διαίρεσης της μίτωσης, διαφέρει από δύο σημαντικές απόψεις:
| ανασυνδυασμός | μείωση | ανακατεύει τα γονίδια μεταξύ των δύο χρωμοσωμάτων σε κάθε ζεύγος (ένα που λαμβάνεται από κάθε γονέα), παράγοντας πολλά ανασυνδυασμένα χρωμοσώματα με μοναδικούς γενετικούς συνδυασμούς σε κάθε γαμέτη | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| μίτωση | εμφανίζεται μόνο εάν χρειάζεται για την αποκατάσταση της βλάβης του DNA. Εμφανίζεται συνήθως μεταξύ ταυτόσημων αδελφών χρωματίδων και δεν οδηγεί σε γενετικές αλλαγές | ||||||||||
| αριθμός χρωμοσωμάτων (πλοειδία) | μείωση | παράγει τέσσερα γενετικά μοναδικά κύτταρα, το καθένα με μισό τον αριθμό των χρωμοσωμάτων του γονέα | |||||||||
| μίτωση | παράγει δύο γενετικά ταυτόσημα κύτταρα, το καθένα με τον ίδιο αριθμό χρωμοσωμάτων με το γονικό | ||||||||||
Η μείωση ξεκινά με ένα διπλοειδές κύτταρο, το οποίο περιέχει δύο αντίγραφα κάθε χρωμοσώματος, που ονομάζονται ομόλογα χρωμοσώματα. Πρώτον, το κύτταρο υφίσταται αντιγραφή του DNA, επομένως κάθε ομόλογο χρωμόσωμα αποτελείται πλέον από δύο όμοιες αδελφές χρωματίδες. Στη συνέχεια, κάθε σύνολο ομόλογων χρωμοσωμάτων ζευγαρώνει μεταξύ τους και ανταλλάσσει γενετικές πληροφορίες με ομόλογο ανασυνδυασμό που οδηγεί συχνά σε φυσικές συνδέσεις (επιχιασμοί) μεταξύ των ομολόγων χρωμοσωμάτων. Στην πρώτη μειωτική διαίρεση, τα ομόλογα χρωμοσώματα διαχωρίζονται για να διαχωριστούν τα θυγατρικά κύτταρα από τη συσκευή ατράκτου. Τα κύτταρα στη συνέχεια προχωρούν σε δεύτερη διαίρεση χωρίς ενδιάμεσο κύκλο αντιγραφής του DNA. Οι αδελφές χρωματίδες διαχωρίζονται σε ξεχωριστά θυγατρικά κύτταρα για να παράγουν συνολικά τέσσερα απλοειδή κύτταρα. Τα θηλυκά ζώα χρησιμοποιούν μια μικρή παραλλαγή σε αυτό το σχέδιο και παράγουν ένα μεγάλο ωάριο και τρία μικρά πολικά σωμάτια. Λόγω του ανασυνδυασμού, μια μεμονωμένη χρωματίδα μπορεί να αποτελείται από έναν νέο συνδυασμό μητρικής και πατρικής γενετικής πληροφορίας, με αποτέλεσμα απογόνους που είναι γενετικά διαφορετικοί από οποιονδήποτε γονέα. Επιπλέον, ένας μεμονωμένος γαμέτης μπορεί να περιλαμβάνει μια ποικιλία από μητρικές, πατρικές και ανασυνδυασμένες χρωματίδες. Αυτή η γενετική ποικιλομορφία που προκύπτει από τη εγγενή αναπαραγωγή συμβάλλει στην ποικιλομορφία των χαρακτηριστικών πάνω στα οποία η μπορεί να δράσει φυσική επιλογή. Η μείωση χρησιμοποιεί πολλούς ίδιους μηχανισμούς με τη μίτωση, τον τύπο κυτταρικής διαίρεσης που χρησιμοποιείται από τους ευκαρυώτες για να διαιρέσει ένα κύτταρο σε δύο όμοια θυγατρικά κύτταρα. Σε ορισμένα φυτά, μύκητες και πρώτιστα η μείωση του έχει ως αποτέλεσμα το σχηματισμό σπορίων: απλοειδή κύτταρα που μπορούν να διαιρεθούν βλαστικά χωρίς να υποστούν γονιμοποίηση. Μερικοί ευκαρυώτες, όπως τα βδελοειδή τροχοφόρα (bdelloid rotifers), δεν έχουν την ικανότητα να πραγματοποιούν τη μείωση και έχουν αποκτήσει την ικανότητα να αναπαράγονται με παρθενογένεση. Η μείωση δεν εμφανίζεται σε αρχαία ή βακτήρια, τα οποία γενικά αναπαράγονται αγενώς μέσω διχοτόμησης. Ωστόσο, μια εγγενής διαδικασία γνωστή ως οριζόντια μεταφορά γονιδίων περιλαμβάνει τη μεταφορά DNA από ένα βακτήριο ή αρχαίο σε άλλο και ανασυνδυασμό αυτών των μορίων DNA διαφορετικής γονικής προέλευσης.
Ιστορικό
[Επεξεργασία | επεξεργασία κώδικα]Η μείωση ανακαλύφθηκε και περιγράφηκε για πρώτη φορά στο αβγό αχινού το 1876 από τον Γερμανό βιολόγο Oscar Hertwig. Περιγράφηκε ξανά το 1883, στο επίπεδο των χρωμοσωμάτων, από τον Βέλγο ζωολόγο Edouard Van Beneden, στα αυγά στρογγυλών σκουληκιών Ascaris. Η σημασία της μείωσης για την αναπαραγωγή και την κληρονομικότητα, ωστόσο, περιγράφηκε μόλις το 1890 από τον Γερμανό βιολόγο Άουγκουστ Βάισμαν, ο οποίος σημείωσε ότι ήταν απαραίτητες δύο κυτταρικές διαιρέσεις για να μετατραπεί ένα διπλοειδές κύτταρο σε τέσσερα απλοειδή κύτταρα, εάν έπρεπε να διατηρηθεί ο αριθμός των χρωμοσωμάτων. Το 1911, ο αμερικανός γενετιστής Τόμας Χαντ Μόργκαν εντόπισε επιχιασμούς στη μείωση στη μύγα των φρούτων Drosophila melanogaster, που βοήθησε να διαπιστωθεί ότι τα γενετικά χαρακτηριστικά μεταδίδονται στα χρωμοσώματα. Ο όρος μείωση προέρχεται από τα ελληνικά και εισήχθη στη βιολογία από τους J.B. Farmer και J.E.S. Moore το 1905.
Φάσεις
[Επεξεργασία | επεξεργασία κώδικα]Η μείωση διαιρείται σε μείωση Ι και μείωση ΙΙ που διαιρούνται περαιτέρω σε Καρυοκίνηση Ι, Κυτταροκίνηση (κυτοκίνηση) Ι, Καρυοκίνηση ΙΙ και Κυτταροκίνηση ΙΙ, αντίστοιχα. Τα προπαρασκευαστικά στάδια που οδηγούν στη μείωση είναι όμοια ως προς το μοτίβο και το όνομα με τη μεσόφαση του μιτωτικού κυτταρικού κύκλου.[8] Η μεσόφαση χωρίζεται σε τρεις φάσεις:
- Φάση ανάπτυξης G1 (gap 1 phase, ή growth 1 phase) (): Σε αυτήν την πολύ ενεργή φάση, το κύτταρο συνθέτει το τεράστιο φάσμα των πρωτεϊνών του, συμπεριλαμβανομένων των ενζύμων και των δομικών πρωτεϊνών που θα χρειαστεί για την ανάπτυξη. Στο G1, κάθε ένα από τα χρωμοσώματα αποτελείται από ένα μόνο γραμμικό μόριο DNA.
- Φάση S (Σύνθεση, Synthesis phase): Το γενετικό υλικό αντιγράφεται. Kαθένα από τα χρωμοσώματα του κυττάρου διπλασιάζεται για να γίνoyn δύο όμοιες αδελφές χρωματίδες που συνδέονται σε ένα κεντρομερίδιο. Αυτή η αντιογραφή δεν αλλάζει την πλοειδία του κυττάρου, αφού ο αριθμός του κεντρομεριδίου παραμένει ο ίδιος. Οι ίδιες αδελφές χρωματίδες δεν έχουν ακόμη συμπυκνωθεί στα πυκνά συσκευασμένα χρωμοσώματα ορατά με το μικροσκόπιο φωτός. Αυτό θα λάβει χώρα κατά τη διάρκεια της πρόφασης Ι στη μείωση.
- Φάση ανάπτυξης G2 (gap 2 phase, ή growth 2 phase): Η φάση G2 όπως φαίνεται πριν από τη μίτωση δεν υπάρχει στη μείωση. Η μειωτική πρόφαση αντιστοιχεί περισσότερο στη φάση G2 του μιτωτικού κυτταρικού κύκλου.
Η μεσόφαση ακολουθείται από τη μείωση Ι και στη συνέχεια τη μείωση ΙΙ. Η μείωση Ι διαχωρίζει τα αναδιπλασιασμένα ομόλογα χρωμοσώματα, που το καθένα εξακολουθεί να αποτελείται από δύο αδελφές χρωματίδες, σε δύο θυγατρικά κύτταρα, μειώνοντας έτσι τον αριθμό των χρωμοσωμάτων στο μισό. Κατά τη διάρκεια της μείωσης II, οι αδελφές χρωματίδες αποσυνδέονται και τα προκύπτοντα θυγατρικά χρωμοσώματα διαχωρίζονται σε τέσσερα θυγατρικά κύτταρα. Για τους διπλοειδείς οργανισμούς, τα θυγατρικά κύτταρα που προκύπτουν από τη μείωση είναι απλοειδή και περιέχουν μόνο ένα αντίγραφο κάθε χρωμοσώματος. Σε ορισμένα είδη, τα κύτταρα εισέρχονται σε μια φάση ηρεμίας γνωστή ως μεσοκίνηση (interkinesis) μεταξύ της μείωσης Ι και της μείωσης II. Η μείωση Ι και ΙΙ χωρίζεται το καθένα σε στάδια πρόφαση, μετάφαση, ανάφαση και τελόφαση, παρόμοια ως προς τον σκοπό με τις ανάλογες υποφάσεις τους στον μιτωτικό κυτταρικό κύκλο. Επομένως, η μείωση περιλαμβάνει τα στάδια της μείωσης Ι (πρόφαση Ι, μετάφαση Ι, ανάφαση Ι, τελόφαση Ι) και της μείωσης II (πρόφαση II, μετάφαση II, ανάφαση II, τελόφαση II).
Κατά τη διάρκεια της μείωσης, συγκεκριμένα γονίδια είναι πιο έντονα μεταγραμμένα.[9][10] Εκτός από την ισχυρή έκφραση του mRNA, ειδική για το μειωτικό στάδιο, υπάρχουν επίσης διάχυτοι μεταφραστικοί έλεγχοι (π.χ. επιλεκτική χρήση προσχηματισμένου mRNA), που ρυθμίζουν την τελική έκφραση πρωτεϊνών των γονιδίων σε μειωτικό στάδιο κατά τη διάρκεια της μείωσης.[11] Έτσι, τόσο οι μεταγραφικοί όσο και οι μεταφραστικοί έλεγχοι καθορίζουν την ευρεία αναδόμηση των μειωτικών κυττάρων που απαιτούνται για τη διεξαγωγή της μείωσης.
Μείωση I
[Επεξεργασία | επεξεργασία κώδικα]Η μείωση I διαχωρίζει ομόλογα χρωμοσώματα, τα οποία ενώνονται ως τετράδες (2n, 4c), παράγοντας δύο απλοειδή κύτταρα (n χρωμοσώματα, 23 στον άνθρωπο) που το καθένα περιέχει χρωματιδικά ζεύγη (1n, 2c). Επειδή η πλοειδία μειώνεται από διπλοειδή σε απλοειδή, η μείωση Ι αναφέρεται ως μειωτική διαίρεση (reductional division). Η μείωση II είναι μια εξισωτική διαίρεση (equational division) ανάλογη με τη μίτωση, στην οποία οι αδελφές χρωματίδες διαχωρίζονται, δημιουργώντας τέσσερα απλοειδή θυγατρικά κύτταρα (1n, 1c).[12]


Πρόφαση I
[Επεξεργασία | επεξεργασία κώδικα]Η πρόφαση Ι είναι μακράν η μεγαλύτερη φάση της μείωσης (διαρκεί 13 στις 14 ημέρες σε ποντίκια [13]). Κατά τη διάρκεια της πρόφασης Ι, τα ομόλογα χρωμοσώματα των μητρικών και πατρικών χρωμοσωμάτων ζευγαρώνουν, σύναψη και ανταλλάσσουν γενετικές πληροφορίες (με ομόλογο ανασυνδυασμό), σχηματίζοντας τουλάχιστον έναν επιχιασμό ανά χρωμόσωμα.[14] Αυτοί οι επιχιασμοί γίνονται ορατοί ως χιάσματα.[15] Αυτή η διαδικασία διευκολύνει το σταθερό ζευγάρωμα μεταξύ ομόλογων χρωμοσωμάτων και ως εκ τούτου επιτρέπει τον ακριβή διαχωρισμό των χρωμοσωμάτων στην πρώτη μειωτική διαίρεση. Τα ζευγαρωμένα και αναδιπλασιασμένα χρωμοσώματα ονομάζονται δισθενή (δύο χρωμοσώματα) ή τετράδες (τέσσερις χρωματίδες), με ένα χρωμόσωμα να προέρχεται από κάθε γονέα. Η πρόφαση Ι διαιρείται σε μια σειρά από υποστάδια που ονομάζονται ανάλογα με την εμφάνιση των χρωμοσωμάτων.
Λεπτοταινία
[Επεξεργασία | επεξεργασία κώδικα]Το πρώτο στάδιο της πρόφασης Ι είναι το στάδιο λεπτοταινία, γνωστό και ως λεπτόνημα.[16]:27 Σε αυτό το στάδιο της πρόφασης Ι, μεμονωμένα χρωμοσώματα - το καθένα αποτελείται από δύο αναδιπλασιασμένες αδελφές χρωματίδες - "εξατομικεύονται" για να σχηματίσουν ορατoύς κλώνους μέσα στον πυρήνα.[16]:27[17]:353 Τα χρωμοσώματα σχηματίζουν το καθένα μια γραμμική διάταξη βρόχων που διαμεσολαβείται από συνεκτίνη (cohesin) και τα πλευρικά στοιχεία του συναπτονηματικού συμπλόκου (synaptonemal complex) συναρμολογούνται σχηματίζοντας ένα αξονικό στοιχείο από το οποίο προέρχονται οι βρόχοι.[18] Ο ανασυνδυασμός ξεκινά σε αυτό το στάδιο από το ένζυμο SPO11 το οποίο δημιουργεί προγραμματισμένες θραύσεις διπλού κλώνου (περίπου 300 ανά μείωση σε ποντίκια).[19] Αυτή η διαδικασία δημιουργεί μονόκλωνα νημάτια DNA επικαλυμμένα από RAD51 και DMC1 που εισβάλλουν στα ομόλογα χρωμοσώματα, σχηματίζοντας γέφυρες μεταξύ των αξόνων και καταλήγοντας στη σύζευξη/συνευθυγράμμιση των ομολόγων χρωμοσωμάτων (σε απόσταση ~400nbsp;nm σε ποντίκια).[18][20]
Ζυγοταινία
[Επεξεργασία | επεξεργασία κώδικα]Η λεπτοταινία ακολουθείται από το στάδιο ζυγοταινίας, γνωστό και ως ζυγόνημα,[16]:27 το οποίο σε ορισμένους οργανισμούς ονομάζεται επίσης στάδιο ανθοδέσμης λόγω του τρόπου με τον οποίο τα τελομερή συσσωματώνονται στο ένα άκρο του πυρήνα.[21] Σε αυτό το στάδιο τα ομόλογα χρωμοσώματα γίνονται πολύ πιο κοντά (~100 nm) και ζευγαρώνουν σταθερά (μια διαδικασία που ονομάζεται σύναψη) με τη μεσολάβηση της εγκατάστασης των εγκάρσιων και κεντρικών στοιχείων του συναπτονηματικού συμπλόκου.[18] Η σύναψη πιστεύεται ότι συμβαίνει με τρόπο που μοιάζει με φερμουάρ, ξεκινώντας από ένα οζίδιο ανασυνδυασμού. Τα ζευγαρωμένα χρωμοσώματα ονομάζονται δισθενή ή τετραδύναμα χρωμοσώματα.
Παχυταινία
[Επεξεργασία | επεξεργασία κώδικα]Το στάδιο παχυταινίας, γνωστό και ως παχύνημα, [16]:27 είναι το στάδιο στο οποίο όλα τα αυτοσωματικά χρωμοσώματα έχουν συναφθεί. Σε αυτό το στάδιο ο ομόλογος ανασυνδυασμός, συμπεριλαμβανομένου του χρωμοσωμικού επιχιασμού ολοκληρώνεται μέσω της επιδιόρθωσης των θραυσμάτων της διπλής έλικας που σχηματίζονται στην λεπτοταινία.[18] Οι περισσότερες θραύσεις επιδιορθώνονται χωρίς να σχηματίζονται επιχιασμοί με αποτέλεσμα τη γονιδιακή μετατροπή.[22] Ωστόσο, ένα υποσύνολο θραύσεων (τουλάχιστον μία ανά χρωμόσωμα) σχηματίζει επιχιασμούς μεταξύ μη αδελφών (ομόλογων) χρωμοσωμάτων με αποτέλεσμα την ανταλλαγή γενετικών πληροφοριών.[23] Η ανταλλαγή πληροφοριών μεταξύ των ομόλογων χρωματίδων οδηγεί σε ανασυνδυασμό πληροφοριών. Κάθε χρωμόσωμα έχει το πλήρες σύνολο πληροφοριών που είχε πριν, και δεν υπάρχουν κενά που σχηματίζονται ως αποτέλεσμα της διαδικασίας. Επειδή τα χρωμοσώματα δεν μπορούν να διακριθούν στο συναπτονηματικό σύμπλοκο, η πραγματική πράξη επιχιασμού δεν γίνεται αντιληπτή μέσω ενός συνηθισμένου μικροσκοπίου φωτός και τα χιάσματα δεν είναι ορατά μέχρι το επόμενο στάδιο.
Διπλοταινία
[Επεξεργασία | επεξεργασία κώδικα]Κατά τη διάρκεια του σταδίου διπλοταινίας, γνωστού και ως διπλονήματος, [16]:30 το συναπτονηματικό σύμπλοκο αποσυναρμολογείται και τα ομόλογα χρωμοσώματα διαχωρίζονται λίγο το ένα από το άλλο. Ωστόσο, τα ομόλογα χρωμοσώματα κάθε δισθενούς παραμένουν στενά συνδεδεμένα στα χιάσματα, στις περιοχές όπου σημειώθηκε ο επιχιασμός. Τα χιάσματα παραμένουν στα χρωμοσώματα μέχρι να αποκοπούν κατά τη μετάβαση στην ανάφαση Ι για να επιτρέψουν στα ομόλογα χρωμοσώματα να μετακινηθούν στους αντίθετους πόλους του κυττάρου. Στην ανθρώπινη εμβρυϊκή ωογένεση, όλα τα αναπτυσσόμενα ωοκύτταρα αναπτύσσονται σε αυτό το στάδιο και σταματούν στην πρόφαση Ι πριν από τη γέννηση.[24] Αυτή η κατάσταση αναστολής αναφέρεται ως δικτυοταινία (dictyotene ή dictyate). Διαρκεί μέχρι να ξαναρχίσει η μείωση για την προετοιμασία των ωοκυττάρων για την ωορρηξία, η οποία συμβαίνει κατά την εφηβεία ή και αργότερα.
Διακίνηση
[Επεξεργασία | επεξεργασία κώδικα]Τα χρωμοσώματα συμπυκνώνονται περαιτέρω κατά τη διάρκεια του σταδίου της διακίνησης.[16]:30 Αυτό είναι το πρώτο σημείο στη μείωση όπου τα τέσσερα μέρη της τετράδας είναι πραγματικά ορατά. Οι θέσεις επιχιασμού εμπλέκονται μεταξύ τους, ουσιαστικά επικαλύπτονται, καθιστώντας τα χιάσματα καθαρά ορατά. Εκτός από αυτήν την παρατήρηση, το υπόλοιπο στάδιο μοιάζει πολύ με την προμετάφαση της μίτωσης. Οι πυρηνίσκοι εξαφανίζονται, η πυρηνική μεμβράνη αποσυντίθεται σε κυστίδια και η μειωτική άτρακτος αρχίζει να σχηματίζεται.
Σχηματισμός μειωτικής ατράκτου
[Επεξεργασία | επεξεργασία κώδικα]Σε αντίθεση με τα μιτωτικά κύτταρα, τα ωοκύτταρα του ανθρώπου και του ποντικού δεν έχουν κεντροσωμάτια για να παράγουν τη μειωτική άτρακτο. Στα ποντίκια, περίπου 80 Κέντρα Οργάνωσης Μικροσωληνίσκων (MicroTubule Organizing Centers, MTOCs) σχηματίζουν μια σφαίρα στο ωόπλασμα και αρχίζουν να σχηματίζουν πυρήνες μικροσωληνίσκων που φτάνουν προς τα χρωμοσώματα, προσκολλώνται στα χρωμοσώματα στον κινητοχώρο (kinetochore). Με την πάροδο του χρόνου, τα MTOC συγχωνεύονται μέχρι να σχηματιστούν δύο πόλοι, δημιουργώντας έναν άξονα σε σχήμα κυλίνδρου.[25] Στα ανθρώπινα ωοκύτταρα η πυρήνωση των μικροσωληνίσκων της ατράκτου αρχίζει στα χρωμοσώματα, σχηματίζοντας έναν αστέρα που τελικά διαστέλλεται για να περιβάλλει τα χρωμοσώματα.[26] Στη συνέχεια, τα χρωμοσώματα γλιστρούν κατά μήκος των μικροσωληνίσκων προς τον ισημερινό της ατράκτου, οπότε οι κινητοχώροι των χρωμοσωμάτων σχηματίζουν ακραία προσαρτήματα σε μικροσωληνίσκους.[27]
Μετάφαση I
[Επεξεργασία | επεξεργασία κώδικα]Τα ομόλογα ζεύγη κινούνται μαζί κατά μήκος της πλάκας μετάφασης: Καθώς οι μικροσωληνίσκοι κινητοχώρων και από τους δύο πόλους της ατράκτου προσκολλώνται στους αντίστοιχους κινητοχώρους τους, τα ζευγαρωμένα ομόλογα χρωμοσώματα ευθυγραμμίζονται κατά μήκος ενός ισημερινού επιπέδου που διχοτομεί την άτρακτο, λόγω των συνεχών δυνάμεων αντιστάθμισης που ασκούνται στα δισθενή από τους μικροσωληνίσκους που προέρχονται από τους δύο κινητοχώρους των ομόλογων χρωμοσωμάτων. Αυτή η προσκόλληση αναφέρεται ως διπολική προσκόλληση. Η φυσική βάση του ανεξάρτητου συνδυασμού (independent assortment) των χρωμοσωμάτων είναι ο τυχαίος προσανατολισμός κάθε δισθενούς κατά μήκος της πλάκας μετάφασης, σε σχέση με τον προσανατολισμό των άλλων δισθενών κατά μήκος της ίδιας ισημερινής γραμμής.[15] Το πρωτεϊνικό σύμπλοκο συνεκτίνης συγκρατεί τις αδελφές χρωματίδες μαζί από τη στιγμή της αντιγραφής τους μέχρι την ανάφαση. Στη μίτωση, η δύναμη των μικροσωληνίσκων κινητοχώρων που έλκονται σε αντίθετες κατευθύνσεις δημιουργεί ένταση. Το κύτταρο αισθάνεται αυτή την τάση και δεν προχωρά με την ανάφαση έως ότου όλα τα χρωμοσώματα είναι σωστά διπροσανατολισμένα. Στη μείωση, η δημιουργία τάσης απαιτεί συνήθως τουλάχιστον έναν επιχιασμό ανά ζεύγος χρωμοσωμάτων επιπλέον της συνεκτίνης μεταξύ των αδελφών χρωματίδων.
Ανάφαση I
[Επεξεργασία | επεξεργασία κώδικα]Οι μικροσωληνίσκοι κινητοχώρων βραχύνονται, τραβώντας τα ομόλογα χρωμοσώματα (τα οποία το καθένα αποτελείται από ένα ζευγάρι αδελφών χρωματίδων) σε αντίθετους πόλους. Οι μικροσωληνίσκοι μη κινητοχώρων επιμηκύνονται, ωθώντας τα κεντροσωμάτια πιο μακριά. Το κύτταρο επιμηκύνεται κατά την προετοιμασία για διαίρεση προς το κέντρο.[15] Σε αντίθεση με τη μίτωση, μόνο η συνεκτίνη από τους βραχίονες του χρωμοσώματος αποικοδομείται, ενώ η συνεκτίνη που περιβάλλει το κεντρομερίδιο παραμένει προστατευμένη από μια πρωτεΐνη που ονομάζεται Shugoshin (ιαπωνικά σημαίνει πνεύμα φύλακα), η οποία εμποδίζει τον διαχωρισμό των αδελφών χρωματίδων.[28] Αυτό επιτρέπει στις αδελφές χρωματίδες να παραμένουν μαζί ενώ τα ομόλογα χρωμοσώματα διαχωρίζονται.
Τελόφαση I
[Επεξεργασία | επεξεργασία κώδικα]Η πρώτη μειωτική διαίρεση τελειώνει ουσιαστικά όταν τα χρωμοσώματα φτάσουν στους πόλους. Κάθε θυγατρικό κύτταρο έχει τώρα τον μισό αριθμό χρωμοσωμάτων, αλλά κάθε χρωμόσωμα αποτελείται από ένα ζευγάρι χρωματίδων. Οι μικροσωληνίσκοι που αποτελούν το δίκτυο της ατράκτου εξαφανίζονται και μια νέα πυρηνική μεμβράνη περιβάλλει κάθε απλοειδές σύνολο. Η κυτταροκίνηση, το τσίμπημα (pinching) της κυτταρικής μεμβράνης στα ζωικά κύτταρα ή ο σχηματισμός του κυτταρικού τοιχώματος στα φυτικά κύτταρα, συμβαίνει, ολοκληρώνοντας τη δημιουργία δύο θυγατρικών κυττάρων. Ωστόσο, η κυτταροκίνηση δεν ολοκληρώνεται πλήρως με αποτέλεσμα τις κυτταροπλασματικές γέφυρες που επιτρέπουν στο κυτταρόπλασμα να μοιράζεται μεταξύ θυγατρικών κυττάρων μέχρι το τέλος της μείωσης II.[29] Οι αδελφές χρωματίδες παραμένουν προσκολλημένες κατά τη διάρκεια της τελόφασης Ι. Τα κύτταρα μπορεί να εισέλθουν σε μια περίοδο ηρεμίας που είναι γνωστή ως μεσοκίνηση (interkinesis) ή μεσόφαση II Δεν λαμβάνει χώρα αντιγραφή του DNA κατά τη διάρκεια αυτού του σταδίου.
Μείωση II
[Επεξεργασία | επεξεργασία κώδικα]Η μείωση II είναι η δεύτερη μειωτική διαίρεση και συνήθως περιλαμβάνει εξισωτικό διαχωρισμό ή διαχωρισμό αδελφών χρωματίδων. Μηχανικά, η διαδικασία είναι παρόμοια με τη μίτωση, αν και τα γενετικά της αποτελέσματα είναι θεμελιωδώς διαφορετικά. Το αποτέλεσμα είναι η παραγωγή τεσσάρων απλοειδών κυττάρων (n χρωμοσώματα, 23 στον άνθρωπο) από τα δύο απλοειδή κύτταρα (με n χρωμοσώματα, το καθένα αποτελούμενο από δύο αδελφές χρωματίδες) που παράγονται στη μείωση Ι. Τα τέσσερα κύρια στάδια της μείωσης II είναι: πρόφαση II, μετάφαση II, ανάφαση II και τελόφαση II. Στην πρόφαση ΙΙ, βλέπουμε την εξαφάνιση των πυρηνίσκων και του πυρηνικού φακέλου και πάλι, καθώς και τη βράχυνση και πάχυνση των χρωματίδων. Τα κεντροσωμάτια κινούνται προς τις πολικές περιοχές και διατάσσουν τις ίνες της ατράκτου για τη δεύτερη μειωτική διαίρεση. Στη μετάφαση II, τα κεντρομερίδια περιέχουν δύο κινητοχώρους που συνδέονται με ίνες της ατράκτου από τα κεντροσωμάτια στους αντίθετους πόλους. Η νέα ισημερινή πλάκα μετάφασης περιστρέφεται κατά 90 μοίρες σε σύγκριση με τη μείωση Ι, κάθετα στην προηγούμενη πλάκα.[30] Ακολουθεί η ανάφαση II, στην οποία η εναπομένουσα κεντρομεριδιακή συνεκτίνη, που δεν προστατεύεται πλέον από το Shugoshin, διασπάται, επιτρέποντας στις αδελφές χρωματίδες να διαχωριστούν. Οι αδελφές χρωματίδες κατά σύμβαση ονομάζονται τώρα αδελφά χρωμοσώματα καθώς κινούνται προς τους αντίθετους πόλους.[28] Η διαδικασία τελειώνει με την τελόφαση ΙΙ, η οποία είναι παρόμοια με την τελόφαση Ι, και χαρακτηρίζεται από αποσυμπύκνωση και επιμήκυνση των χρωμοσωμάτων και αποσυναρμολόγηση της ατράκτου. Οι πυρηνικοί φάκελοι επανασχηματίζονται και η διάσπαση ή ο σχηματισμός κυτταρικής πλάκας παράγει τελικά συνολικά τέσσερα θυγατρικά κύτταρα, το καθένα με ένα απλοειδές σύνολο χρωμοσωμάτων. Η μείωση έχει πλέον ολοκληρωθεί και καταλήγει με τέσσερα νέα θυγατρικά κύτταρα.
Προέλευση και λειτουργία
[Επεξεργασία | επεξεργασία κώδικα]Προέλευση της μείωσης
[Επεξεργασία | επεξεργασία κώδικα]Η μείωση φαίνεται να είναι ένα θεμελιώδες χαρακτηριστικό των ευκαρυωτικών οργανισμών και να ήταν παρούσα νωρίς στην ευκαρυωτική εξέλιξη. Οι ευκαρυώτες που κάποτε πίστευαν ότι δεν είχαν μειωτικό φύλο έχει πρόσφατα αποδειχθεί ότι πιθανότατα είχαν, ή είχαν κάποτε, αυτή την ικανότητα. Ως παράδειγμα, το Giardia intestinalis, ένα κοινό εντερικό παράσιτο, θεωρήθηκε προηγουμένως ότι προέρχεται από μια γενεαλογία που προϋπήρχε της εμφάνισης της μείωσης και του φύλου. Ωστόσο έχει πλέον βρεθεί ότι το G. intestinalis διαθέτει ένα βασικό σύνολο μειωτικών γονιδίων, συμπεριλαμβανομένων πέντε γονιδίων ειδικά για τη μείωση.[31] Επίσης στοιχεία για τον μειωτικό ανασυνδυασμό, ενδεικτικά της εγγενούς αναπαραγωγής, βρέθηκαν στο G. intestinalis.[32] Ένα άλλο παράδειγμα οργανισμών που προηγουμένως θεωρούνταν άφυλοι είναι τα παρασιτικά πρωτόζωα του γένους Leishmania, τα οποία προκαλούν ασθένειες στον άνθρωπο. Ωστόσο, αυτοί οι οργανισμοί αποδείχθηκε ότι έχουν έναν φυλετικό κύκλο συμβατό με μειωτική διαδικασία.[33] Αν και η αμοιβάδα κάποτε θεωρούνταν γενικά αφυλετική, έχουν παρουσιαστεί στοιχεία ότι οι περισσότερες γενεαλογίες ήταν παλιά φυλετικές και ότι η πλειοψηφία των αφυλετικών ομάδων πιθανότατα προέκυψε πρόσφατα και ανεξάρτητα.[34] Οι Dacks και Rogers[35] με βάση μια φυλογενετική ανάλυση, ότι το προαιρετικό φύλο ήταν πιθανό να υπάρχει στον κοινό πρόγονο των ευκαρυωτών.
Γενετική παραλλαγή
[Επεξεργασία | επεξεργασία κώδικα]Οι νέοι συνδυασμοί DNA που δημιουργούνται κατά τη διάρκεια της μείωσης αποτελούν σημαντική πηγή γενετικών παραλλαγών παράλληλα με τη μετάλλαξη, με αποτέλεσμα νέους συνδυασμούς αλληλομόρφων, που μπορεί να είναι ευεργετικοί. Η μείωση δημιουργεί γενετική ποικιλότητα γαμετών με δύο τρόπους: (1) Νόμος του ανεξάρτητου συνδυασμού. Ο ανεξάρτητος προσανατολισμός των ομόλογων ζευγών χρωμοσωμάτων κατά μήκος της πλάκας μετάφασης κατά τη διάρκεια της μετάφασης Ι και ο προσανατολισμός των αδελφών χρωματίδων στη μετάφαση II, και ο επακόλουθος διαχωρισμός ομολόγων χρωμοσωμάτων και αδελφών χρωματίδων κατά τη διάρκεια της ανάφασης Ι και ΙΙ, επιτρέπει μια τυχαία και ανεξάρτητη κατανομή των χρωμοσωμάτων σε κάθε θυγατρικό κύτταρο (και τελικά στους γαμέτες)[36] και (2) οι επιχιασμοί. Η φυσική ανταλλαγή των ομολόγων χρωμοσωμικών περιοχών με ομόλογο ανασυνδυασμό κατά τη διάρκεια της πρόφασης Ι οδηγεί σε νέους συνδυασμούς των γενετικών πληροφοριών εντός των χρωμοσωμάτων.[37] Ωστόσο, μια τέτοια φυσική ανταλλαγή δεν συμβαίνει πάντα κατά τη διάρκεια της μείωσης. Στα ωοκύτταρα του μεταξοσκώληκα Bombyx mori, η μείωση είναι εντελώς αχιασματική (λείπουν οι επιχιασμοί).[38] Αν και τα συναπτονηματικά σύμπλοκα είναι παρόντα κατά το στάδιο της παχυταινίας της μείωσης στο Β. mori, ο επιχιασμός ομόλογου ανασυνδυασμού απουσιάζει μεταξύ των ζευγαρωμένων χρωμοσωμάτων.[39]
Ανακοπή πρόφασης I
[Επεξεργασία | επεξεργασία κώδικα]Τα θηλυκά θηλαστικά και τα πτηνά γεννιούνται με όλα τα ωοκύτταρα που χρειάζονται για μελλοντικές ωορρηξίες και αυτά τα ωοκύτταρα σταματούν στο στάδιο I της μείωσης.[40] Στους ανθρώπους, για παράδειγμα, τα ωοκύτταρα σχηματίζονται μεταξύ τριών και τεσσάρων μηνών κύησης μέσα στο έμβρυο και επομένως υπάρχουν κατά τη γέννηση. Κατά τη διάρκεια αυτής της πρόφασης Ι που σταμάτησε στο στάδιο (δικτυοταινίας), το οποίο μπορεί να διαρκέσει για δεκαετίες, τέσσερα αντίγραφα του γονιδιώματος υπάρχουν στα ωοκύτταρα. Η ανακοπή των ωοκυττάρων στο τέταρτο στάδιο αντιγραφής του γονιδιώματος προτάθηκε ότι παρέχει τον πλεονασμό πληροφοριών που απαιτούνται για την επιδιόρθωση του DNA της βλαστικής γραμμής.[40] Η διαδικασία επιδιόρθωσης που χρησιμοποιείται φαίνεται να περιλαμβάνει επιδιόρθωση του ομόλογου ανασυνδυασμού [40][41] Τα ωοκύτταρα που έχουν διακοπεί από την Προφάση Ι έχουν υψηλή ικανότητα για αποτελεσματική επιδιόρθωση βλαβών του DNA, ιδιαίτερα εξωγενώς επαγόμενα θραύσεων διπλού κλώνου.[41] Η ικανότητα επιδιόρθωσης του DNA φαίνεται να είναι ένας βασικός μηχανισμός ποιοτικού ελέγχου στη γυναικεία βλαστική γραμμή και ένας κρίσιμος καθοριστικός παράγοντας της γονιμότητας.[41]
Η μείωση ως προσαρμογή για την επιδιόρθωση του βλαστικού DNA
[Επεξεργασία | επεξεργασία κώδικα]Ο γενετικός ανασυνδυασμός μπορεί να θεωρηθεί βασικά ως μια διαδικασία επιδιόρθωσης του DNA και ότι όταν συμβαίνει κατά τη διάρκεια της μείωσης είναι μια προσαρμογή για την επιδιόρθωση του γονιδιωματικού DNA που μεταβιβάζεται στους απογόνους.[42][43] Πειραματικά ευρήματα υποδεικνύουν ότι ένα σημαντικό όφελος της μείωσης είναι η ανασυνδυαστική επιδιόρθωση των βλαβών του DNA στη βλαστική γραμμή, όπως υποδεικνύεται από τα ακόλουθα παραδείγματα. Το υπεροξείδιο του υδρογόνου είναι ένας παράγοντας που προκαλεί οξειδωτικό στρες που οδηγεί σε οξειδωτική βλάβη του DNA.[44] Η θεραπεία της ζύμης Schizosaccharomyces pombe με υπεροξείδιο του υδρογόνου αύξησε τη συχνότητα του ζευγαρώματος και τον σχηματισμό μειωτικών σπορίων κατά 4 έως 18 φορές.[45] Το Volvox carteri, ένα απλοειδές πολυκύτταρο, προαιρετικά φυλετικών πράσινων φυκιών, που μπορεί να προκληθεί από θερμικό σοκ για να αναπαραχθεί με μειωτικό φύλο.[46] Αυτή η επαγωγή μπορεί να ανασταλεί από αντιοξειδωτικά που υποδεικνύουν ότι η πρόκληση μειωτικού φύλου από θερμικό σοκ μεσολαβείται πιθανώς από οξειδωτικό στρες που οδηγεί σε αυξημένη βλάβη του DNA.[47]
Εμφάνιση
[Επεξεργασία | επεξεργασία κώδικα]Σε κύκλους ζωής
[Επεξεργασία | επεξεργασία κώδικα]

Η μείωση εμφανίζεται σε ευκαρυωτικούς κύκλους ζωής που περιλαμβάνουν εγγενή αναπαραγωγή, που αποτελείται από την κυκλική διαδικασία αύξησης και ανάπτυξης με μιτωτική κυτταρική διαίρεση, παραγωγή γαμετών με μείωση και γονιμοποίηση. Σε ορισμένα στάδια του κύκλου της ζωής, τα βλαστικά κύτταρα παράγουν γαμέτες. Τα σωματικά κύτταρα αποτελούν το σώμα του οργανισμού και δεν εμπλέκονται στην παραγωγή γαμετών. Η κυκλική μείωση και τα γεγονότα γονιμοποίησης έχουν ως αποτέλεσμα την εναλλαγή μεταξύ απλοειδών και διπλοειδών καταστάσεων. Η φάση του οργανισμού του κύκλου ζωής μπορεί να συμβεί είτε κατά τη διπλοειδή κατάσταση (διπλοντικός κύκλος ζωής), κατά τη διάρκεια της απλοειδούς κατάστασης (απλοντικός κύκλος ζωής), ή και τα δύο (απλοδιπλοντικός κύκλος ζωής), όπου υπάρχουν δύο διακριτές φάσεις του οργανισμού, η μία με απλοειδή κύτταρα και η άλλη με διπλοειδή κύτταρα. Στον διπλοντικό κύκλο ζωής (με προγαμετική μείωση), όπως και στους ανθρώπους, ο οργανισμός είναι πολυκύτταρος και διπλοειδής, που αναπτύσσεται με μίτωση από ένα διπλοειδές κύτταρο που ονομάζεται ζυγώτης. Τα διπλοειδή βλαστοκύτταρα της βλαστικής γραμμής του οργανισμού υφίστανται μείωση για να δημιουργήσουν απλοειδή γαμέτες (τα σπερματοζωάρια στα αρσενικά και τα ωάρια στα θηλυκά), οι οποίοι γονιμοποιούνται για να σχηματίσουν τον ζυγώτη. Ο διπλοειδής ζυγώτης υφίσταται επαναλαμβανόμενη κυτταρική διαίρεση με μίτωση για να αναπτυχθεί στον οργανισμό Στον απλοντικό κύκλο ζωής (με μεταζυγωτική μείωση), ο οργανισμός είναι απλοειδής, με τον πολλαπλασιασμό και τη διαφοροποίηση ενός απλοειδούς κυττάρου που ονομάζεται γαμέτης. Δύο οργανισμοί αντίθετου φύλου συνεισφέρουν τους απλοειδείς γαμέτες τους στο σχηματισμό ενός διπλοειδούς ζυγώτη. Ο ζυγώτης υφίσταται μείωση αμέσως, δημιουργώντας τέσσερα απλοειδή κύτταρα. Αυτά τα κύτταρα υφίστανται μίτωση για να δημιουργήσουν τον οργανισμό. Πολλοί μύκητες και πολλά πρωτόζωα χρησιμοποιούν τον απλοειδή κύκλο ζωής. Στον απλοδιπλοντικό κύκλο ζωής (με σπορική ή ενδιάμεση μείωση), ο ζωντανός οργανισμός εναλλάσσεται μεταξύ απλοειδών και διπλοειδών καταστάσεων. Κατά συνέπεια, αυτός ο κύκλος είναι επίσης γνωστός ως εναλλαγή γενεών. Τα κύτταρα βλαστικής γραμμής του διπλοειδούς οργανισμού υφίστανται μείωση για να παράγουν σπόρια. Τα σπόρια πολλαπλασιάζονται με μίτωση και αναπτύσσονται σε απλοειδή οργανισμό. Στη συνέχεια, ο γαμέτης του απλοειδούς οργανισμού συνδυάζεται με τον γαμέτη ενός άλλου απλοειδούς οργανισμού, δημιουργώντας τον ζυγώτη. Ο ζυγώτης υφίσταται επαναλαμβανόμενη μίτωση και διαφοροποίηση για την παραγωγή ενός νέου διπλοειδούς οργανισμού. Ο απλοδιπλοντικός κύκλος ζωής μπορεί να θεωρηθεί ως συγχώνευση του διπλοντικού και απλοντικού κύκλου ζωής.[48]
Σε φυτά και ζώα
[Επεξεργασία | επεξεργασία κώδικα]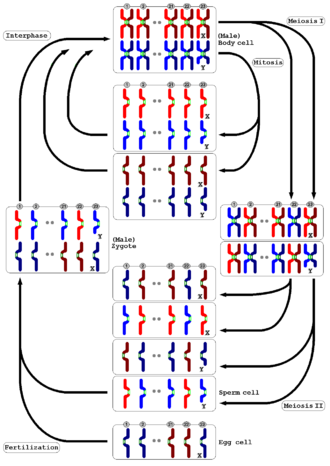
Η μείωση εμφανίζεται σε όλα τα ζώα και τα φυτά. Το αποτέλεσμα, η παραγωγή γαμετών με το μισό αριθμό χρωμοσωμάτων όπως το γονικό κύτταρο, είναι το ίδιο, αλλά η λεπτομερής διαδικασία είναι διαφορετική. Στα ζώα, η μείωση παράγει απευθείας γαμέτες. Στα φυτά της ξηράς και σε ορισμένα φύκια, υπάρχει μια εναλλαγή γενεών τέτοια ώστε η μείωση στη γενιά των διπλοειδών σπορόφυτων παράγει απλοειδή σπόρια αντί για γαμέτες. Όταν βλαστήσουν, αυτά τα σπόρια υφίστανται επαναλαμβανόμενη κυτταρική διαίρεση με μίτωση, εξελισσόμενη σε μια πολυκυτταρική απλοειδή γαμετόφυτη γενιά, η οποία στη συνέχεια παράγει γαμέτες απευθείας (δηλαδή χωρίς περαιτέρω μείωση). Τόσο στα ζώα όσο και στα φυτά, το τελικό στάδιο είναι να συγχωνευτούν οι γαμέτες για να σχηματίσουν έναν ζυγώτη στον οποίο αποκαθίσταται ο αρχικός αριθμός των χρωμοσωμάτων.[49]
Στα θηλαστικά
[Επεξεργασία | επεξεργασία κώδικα]Στα θηλυκά, η μείωση εμφανίζεται σε κύτταρα γνωστά ως ωοκύτταρα. Κάθε πρωτογενές ωοκύτταρο διαιρείται δύο φορές σε μείωση, άνισα σε κάθε περίπτωση. Η πρώτη διαίρεση παράγει ένα θυγατρικό κύτταρο και ένα πολύ μικρότερο πολικό σώμα το οποίο μπορεί να υποβληθεί ή όχι σε δεύτερη διαίρεση. Στη μείωση II, η διαίρεση του θυγατρικού κυττάρου παράγει ένα δεύτερο πολικό σώμα και ένα μόνο απλοειδές κύτταρο, το οποίο μεγεθύνεται για να γίνει ωάριο. Επομένως, στα θηλυκά κάθε πρωτογενές ωοκύτταρο που υφίσταται μείωση έχει ως αποτέλεσμα ένα ώριμο ωάριο και δύο ή τρία πολικά σώματα. Υπάρχουν παύσεις κατά τη διάρκεια της μείωσης στα θηλυκά. Τα ώριμα ωοκύτταρα σταματούν στην πρόφαση Ι της μείωσης Ι και βρίσκονται σε αδράνεια μέσα σε ένα προστατευτικό κέλυφος σωματικών κυττάρων που ονομάζεται ωοθυλάκιο. Σε αυτό το στάδιο, ο πυρήνας του ωοκυττάρου ονομάζεται βλαστικό κυστίδιο (germinal vesicle).[50] Στην αρχή κάθε καταμήνιου κύκλου, η έκκριση FSH από την πρόσθια υπόφυση διεγείρει μερικά ωοθυλάκια να ωριμάσουν σε μια διαδικασία γνωστή ως θυλακιογένεση. Κατά τη διάρκεια αυτής της διαδικασίας, τα ωοκύτταρα που ωριμάζουν συνεχίζουν τη μείωση και συνεχίζουν μέχρι τη μετάφαση II της μείωσης II, όπου σταματούν και πάλι λίγο πριν την ωορρηξία. Η διάσπαση του βλαστικού κυστιδίου, η συμπύκνωση των χρωμοσωμάτων και η συναρμολόγηση της διπολικής ατράκτου της μεταφάσης Ι είναι όλα σαφείς ενδείξεις ότι η μείωση έχει επανέλθει.[50]. Εάν αυτά τα ωοκύτταρα γονιμοποιηθούν από το σπέρμα, θα συνεχίσουν και θα ολοκληρώσουν τη μείωση. Κατά τη διάρκεια της ωοθυλακιογένεσης στον άνθρωπο, συνήθως ένα ωοθυλάκιο γίνεται κυρίαρχο ενώ τα άλλα υφίστανται ατρησία. Η διαδικασία της μείωσης στα θηλυκά συμβαίνει κατά τη διάρκεια της ωογένεσης και διαφέρει από την τυπική μείωση στο ότι χαρακτηρίζεται από μια μακρά περίοδο μειωτικής ανακοπής γνωστή ως δικτυακό στάδιο και δεν έχει τη βοήθεια κεντροσωματίων.[51][52] Στα αρσενικά, η μείωση εμφανίζεται κατά τη διάρκεια της σπερματογένεσης στα σπερματικά σωληνάρια των όρχεων. Η μείωση κατά τη διάρκεια της σπερματογένεσης είναι ειδική για έναν τύπο κυττάρου που ονομάζεται σπερματοκύτταρα, τα οποία θα ωριμάσουν αργότερα για να γίνουν σπερματοζωάρια. Η μείωση των αρχέγονων γεννητικών κυττάρων συμβαίνει κατά την εφηβεία, πολύ αργότερα από ότι στα θηλυκά. Οι ιστοί του αρσενικού όρχεως καταστέλλουν τη μείωση μέσω της αποδόμησης του ρετινοϊκού οξέος, που προτείνεται ότι είναι ο διεγέρτης της μείωσης. Αυτό ξεπερνιέται στην εφηβεία, όταν τα κύτταρα εντός των σπερματικών σωληναρίων που ονομάζονται κύτταρα Sertoli αρχίζουν να παράγουν το δικό τους ρετινοϊκό οξύ. Η ευαισθησία στο ρετινοϊκό οξύ ρυθμίζεται επίσης από πρωτεΐνες που ονομάζονται nanos και DAZL.[53][54] Μελέτες γενετικής απώλειας λειτουργίας σε ένζυμα που δημιουργούν ρετινοϊκό οξύ έχουν δείξει ότι το ρετινοϊκό οξύ απαιτείται μεταγεννητικά για να διεγείρει τη διαφοροποίηση της σπερματογονίας που έχει ως αποτέλεσμα αρκετές ημέρες αργότερα τα σπερματοκύτταρα να υφίστανται μείωση. Ωστόσο, το ρετινοϊκό οξύ δεν απαιτείται κατά τη διάρκεια της έναρξης της μείωσης.[55] Στα θηλυκά θηλαστικά, η μείωση ξεκινά αμέσως μετά τη μετανάστευση των αρχέγονων γεννητικών κυττάρων στην ωοθήκη του εμβρύου. Ορισμένες μελέτες υποδεικνύουν ότι το ρετινοϊκό οξύ που προέρχεται από τον πρωτόγονο νεφρό (μεσόνεφρος) διεγείρει τη μείωση στην ωογονία των εμβρυϊκών ωοθηκών και ότι οι ιστοί του εμβρυϊκού αρσενικού όρχεως καταστέλλουν τη μείωση αποικοδομώντας το ρετινοϊκό οξύ.[56] Ωστόσο, μελέτες γενετικής απώλειας λειτουργίας σε ένζυμα που παράγουν ρετινοϊκό οξύ έχουν δείξει ότι το ρετινοϊκό οξύ δεν απαιτείται για την έναρξη της θηλυκής μείωσης που συμβαίνει κατά τη διάρκεια της εμβρυογένεσης, [57] ή για την αρσενική μείωση που ξεκινά μεταγεννητικά.[55]
Μαστιγοφόρα
[Επεξεργασία | επεξεργασία κώδικα]Ενώ η πλειονότητα των ευκαρυωτών έχει μια διμερή μείωση (αν και μερικές φορές αχιασματική, μια πολύ σπάνια μορφή, μονομερής μείωση, εμφανίζεται σε μερικά μαστιγωτά (parabasalids και oxymonads) από το έντερο της κατσαρίδας Cryptocercus που τρέφεται με ξύλο.[58]
Ρόλος στην ανθρώπινη γενετική και τις ασθένειες
[Επεξεργασία | επεξεργασία κώδικα]Ο ανασυνδυασμός μεταξύ των 23 ζευγών ανθρώπινων χρωμοσωμάτων είναι υπεύθυνος για την ανακατανομή όχι μόνο των πραγματικών χρωμοσωμάτων, αλλά και τμημάτων καθενός από αυτά. Υπολογίζεται επίσης 1,6 φορές περισσότερος ανασυνδυασμός στις γυναίκες σε σχέση με τους άνδρες. Επιπλέον, κατά μέσο όρο, ο γυναικείος ανασυνδυασμός είναι υψηλότερος στα κεντρομερίδια και ο αρσενικός ανασυνδυασμός είναι υψηλότερος στα τελομερή. Κατά μέσο όρο, 1 εκατομμύριο ζεύγη δεσμών (1 Mb) αντιστοιχούν σε 1 cMorgan (cM = 1% συχνότητα ανασυνδυασμού).[59] Η συχνότητα των επιχιασμών παραμένει αβέβαιη. Σε ζυμομύκητες, ποντίκια και ανθρώπους, έχει υπολογιστεί ότι σχηματίζονται ≥200 θραύσματα διπλού κλώνου (double-strand breaks, DSBs) ανά μειωτικό κύτταρο. Ωστόσο, μόνο ένα υποσύνολο DSB (~5–30% ανάλογα με τον οργανισμό) συνεχίζει να παράγει επιχιασμούς,[60] που θα είχε ως αποτέλεσμα μόνο 1-2 επιχιασμούς ανά ανθρώπινο χρωμόσωμα. Στον άνθρωπο, τα ποσοστά ανασυνδυασμού διαφέρουν μεταξύ μητρικού και πατρικού DNA:
- Μητρικό DNA: Ανασυνδυάζεται περίπου 42 φορές κατά μέσο όρο.
- Πατρικό DNA: Ανασυνδυάζεται περίπου 27 φορές κατά μέσο όρο.
Μη διαχωρισμός
[Επεξεργασία | επεξεργασία κώδικα]Η φυσιολογική αποσύνδεση των χρωμοσωμάτων στη μείωση Ι ή των αδελφών χρωματίδων στη μείωση ΙΙ ονομάζεται διαχωρισμός (disjunction). Όταν ο διαχωρισμός δεν είναι φυσιολογικός, ονομάζεται μη διαχωρισμός (nondisjunction). Αυτό έχει ως αποτέλεσμα την παραγωγή γαμετών που έχουν είτε πάρα πολλά, είτε πολύ λίγα από ένα συγκεκριμένο χρωμόσωμα και είναι ένας συνηθισμένος μηχανισμός για τρισωμία ή μονοσωμία. Ο μη διαχωρισμός μπορεί να συμβεί στη μείωση Ι ή μείωση II, σε φάσεις κυτταρικής αναπαραγωγής, ή κατά τη διάρκεια της μίτωσης. Τα περισσότερα μονοσωμικά και τρισωμικά ανθρώπινα έμβρυα δεν είναι βιώσιμα, αλλά ορισμένες ανευπλοειδίες μπορούν να γίνουν ανεκτές, όπως η τρισωμία για το μικρότερο χρωμόσωμα, το χρωμόσωμα 21. Οι φαινότυποι αυτών των ανευπλοειδιών κυμαίνονται από σοβαρές αναπτυξιακές διαταραχές έως ασυμπτωματικές. Οι ιατρικές καταστάσεις περιλαμβάνουν, αλλά δεν περιορίζονται σε:
- Σύνδρομο Ντάουν – τρισωμία του χρωμοσώματος 21
- Σύνδρομο Πατάου – τρισωμία του χρωμοσώματος 13
- Σύνδρομο Έντουαρντς – τρισωμία του χρωμοσώματος 18
- Σύνδρομο Κλαϊνφέλτερ – επιπλέον χρωμοσώματα Χ στους άνδρες – δηλ. XXY, XXXY, XXXXY, κ.λπ.
- Σύνδρομο Τέρνερ – έλλειψη ενός χρωμοσώματος Χ στις γυναίκες – δηλ. X0
- Σύνδρομο Τριπλού Χ – ένα επιπλέον χρωμόσωμα Χ στις γυναίκες
- Σύνδρομο Γιάκομπς – ένα επιπλέον χρωμόσωμα Υ στους άνδρες.
Η πιθανότητα μη διαχωρισμού στα ανθρώπινα ωοκύτταρα αυξάνεται με την αύξηση της ηλικίας της μητέρας,[61] πιθανώς λόγω απώλειας συνεκτίνης με την πάροδο του χρόνου.[62]
Σύγκριση με τη μίτωση
[Επεξεργασία | επεξεργασία κώδικα]Για να κατανοήσουμε τη μείωση, μια σύγκριση με τη μίτωση είναι χρήσιμη. Ο παρακάτω πίνακας δείχνει τις διαφορές μεταξύ μείωσης και μίτωσης.[63]
| Μείωση | Μίτωση | |
|---|---|---|
| Τελικό αποτέλεσμα | Κανονικά τέσσερα κύτταρα, το καθένα με τον μισό αριθμό των χρωμοσωμάτων του γονέα | Δύο κύτταρα, που έχουν τον ίδιο αριθμό χρωμοσωμάτων με τον γονέα |
| Λειτουργία | Παραγωγή γαμετών (φυλετικά κύτταρα) σε φυλετικά αναπαραγόμενους ευκαρυώτες με διπλοντικό κύκλο ζωής | Κυτταρική αναπαραγωγή, ανάπτυξη, επιδιόρθωση, αφυλετική αναπαραγωγή |
| Πού συμβαίνει; | Σχεδόν σε όλους τους ευκαρυώτες (ζώα, φυτά, μύκητες και πρώτιστα).[64][58] Στις γονάδες, πριν από τους γαμέτες (σε διπλοντικούς κύκλους ζωής). Μετά τους ζυγώτες (σε απλοντικά). Πριν τα σπόρια (σε απλοδιπλοντικά) |
Σε όλα τα πολλαπλασιαζόμενα κύτταρα σε όλους τους ευκαρυώτες |
| Στάδια | Πρόφαση Ι, Μετάφαση Ι, Ανάφαση Ι, Τελόφαση Ι, Πρόφαση ΙΙ, Μετάφαση ΙΙ, Ανάφαση ΙΙ, Τελόφαση ΙΙ |
Πρόφαση, Προμετάφαση, Μετάφαση, Ανάφαση, Τελόφαση |
| Γενετικά ίδιο με τον γονέα; | Όχι | Ναι |
| Συμβαίνει επιχιασμός; | Ναι, κανονικά εμφανίζεται μεταξύ κάθε ζεύγους ομόλογων χρωμοσωμάτων | Πολύ σπάνια |
| Σύζευξη των ομόλογων χρωμοσωμάτων | Ναι | Όχι |
| Κυτταροκίνηση | Συμβαίνει στην Τελόφαση Ι και Τελόφαση ΙΙ | Συμβαίνει στη Τελόφαση |
| Τα κεντρομερίδια χωρίζονται | Δεν συμβαίνει στην Ανάφαση Ι, αλλά συμβαίνει στην Ανάφαση ΙΙ | Συμβαίνει στην Ανάφαση |
Μοριακή ρύθμιση
[Επεξεργασία | επεξεργασία κώδικα]Ο παράγοντας προαγωγής ωρίμανσης (Maturation promoting factor, MPF) φαίνεται να παίζει ρόλο στη μείωση με βάση πειράματα με ωοκύτταρα Xenopus laevis. Ο MPF ωοκυττάρων θηλαστικών προκάλεσε διάσπαση βλαστικών κυστιδίων (germinal vesicle breakdown, GVB) σε αστερίες και ωοκύτταρα Xenopus laevis.[65] Ο MPF είναι ενεργός πριν από τον GVB αλλά μειώνεται προς το τέλος της μείωσης Ι.[66] Τα επίπεδα CDK1 και κυκλίνης Β συσχετίζονται με την ικανότητα του GVB του ωαρίου και είναι πιθανόν κάτω από μεταφραστικό και όχι μεταγραφικό έλεγχο.[50] Στη μείωση II, ο MPF επανεμφανίζεται πριν από τη μετάφαση II και η δραστηριότητά του παραμένει υψηλή μέχρι τη γονιμοποίηση.[66][67] Στα θηλαστικά, η μειωτική ανακοπή ξεκινά με νατριουρητικό πεπτίδιο τύπου C (NPPC) από κύτταρα κοκκιώδους τοιχώματος, το οποίο ενεργοποιεί την παραγωγή κυκλικής 3',5'-μονοφωσφορικής γουανοσίνης (cGMP) σε συνεννόηση με τον υποδοχέα νατριουρητικού πεπτιδίου 2 (NPR2) στα κύτταρα σωρών.[68] Το cGMP διαχέεται στα ωοκύτταρα και σταματά τη μείωση αναστέλλοντας την υδρόλυση της φωσφοδιεστεράσης 3Α (PDE3A) και της κυκλικής 3',5'-μονοφωσφορικής αδενοσίνης (cAMP).[68] Στο ωοκύτταρο, ο συζευγμένος με G-πρωτεΐνη υποδοχέας GPR3/12 ενεργοποιεί την αδενυλυλοκυκλάση για τη δημιουργία cAMP.[68] Το cAMP διεγείρει την πρωτεϊνική κινάση Α (PKA) για να ενεργοποιήσει την πυρηνική κινάση WEE2 με φωσφορυλίωση.[69] Το PKA βοηθά επίσης στη φωσφορυλίωση της CDK1 φωσφατάσης CDC25B για να διατηρηθεί στο κυτταρόπλασμα. Στη μη φωσφορυλιωμένη του μορφή, το CDC25B μεταναστεύει στον πυρήνα.[50][69] Η πρωτεϊνική κινάση C (PKC) μπορεί επίσης να έχει ρόλο στην αναστολή της μειωτικής εξέλιξης στη μετάφαση II.[50] Συνολικά, η δραστηριότητα του CDK1 καταστέλλεται για να αποτραπεί η συνέχιση της μείωσης.[69] Τα ωοκύτταρα προάγουν περαιτέρω την έκφραση του NPR2 και της αφυδρογονάσης της μονοφωσφορικής ινοσίνης (και επομένως την παραγωγή cGMP) σε κύτταρα σωρού.[68] Η ωοθυλακιοτρόπος ορμόνη και η οιστραδιόλη προάγουν επίσης την έκφραση των NPPC και NPR2.[68] Η υποξανθίνη, μια πουρίνη που προέρχεται προφανώς από το ωοθυλάκιο, αναστέλλει επίσης τη μείωση των ωοκυττάρων εργαστηριακά.[70] Η αύξηση της ωχρινοτρόπου ορμόνης (LH) διεγείρει την ωρίμανση των ωοκυττάρων,[68] στην οποία τα ωοκύτταρα απελευθερώνονται από τη μειωτική ανακοπή και προχωρούν από την προφάση Ι έως τη μετάφαση II.[70] Παράγοντες που μοιάζουν με επιδερμικό αυξητικό παράγοντα που προκαλούνται από την LH, όπως η αμφιρεγκουλίνη και η επιρεουλίνη [70] που συντίθενται σε κύτταρα κοκκιώδους τοιχώματος μειώνουν τα επίπεδα της cGMP στα ωοκύτταρα περιορίζοντας τη μεταφορά cGMP μέσω συνδέσεων χάσματος σωρευμένου κυττάρου-ωοκυττάρου και μειώνοντας τα επίπεδα NPPC και τη δραστηριότητα NPR2.[69][68] Στην πραγματικότητα, παράγοντες που μοιάζουν με επιδερμικούς αυξητικούς παράγοντες που προκαλούνται από την LH μπορεί να προκαλέσουν την αποσταθεροποίηση και τη διάσπαση των συνδέσμων κενών συνολικά.[70] Παράγοντες που μοιάζουν με επιδερμικό αυξητικό παράγοντα που προκαλούνται από την LH μπορεί να πυροδοτήσουν την παραγωγή πρόσθετων παραγόντων ωρίμανσης ωοκυττάρων όπως τα στεροειδή και η στερόλη που ενεργοποιεί τη μείωση που προέρχεται από το ωοθυλακικό υγρό (follicular fluid-derived meiosis-activating, FF-MAS) σε κύτταρα σωρού.[70] Το FF-MAS προάγει την εξέλιξη από τη μετάφαση Ι στη μετάφαση II και μπορεί να βοηθήσει στη σταθεροποίηση της ανακοπής της μετάφασης ΙΙ.[70] Η συνέχιση της μείωσης ενισχύεται από την έξοδο του WEE2 από τον πυρήνα λόγω της ενεργοποίησης του CDK1.[69] Οι φωσφοδιεστεράσες (PDEs) μεταβολίζουν το cAMP και μπορεί να ενεργοποιηθούν προσωρινά με φωσφορυλίωση που προκαλείται από PKA.[70] Η μακροπρόθεσμη ρύθμιση των φωσφοδιεστερασών μπορεί να απαιτεί τροποποίηση της πρωτεϊνικής έκφρασης.[70] Παραδείγματος χάρη, η υποξανθίνη είναι ένας αναστολέας PDE που μπορεί να εμποδίσει το μεταβολισμό του cAMP..[70] Οι κινάσες όπως η πρωτεϊνική κινάση Β, η κινάση Aurora A και η κινάση τύπου polo 1 συμβάλλουν στην συνέχιση της μείωσης.[69] Υπάρχουν ομοιότητες μεταξύ των μηχανισμών ανακοπής και συνέχισης της μειωτικής προφάσης Ι και του σημείου ελέγχου βλάβης του μιτωτικού G2 του DNA: ενεργοποίηση του APC-CDH1 με βάση το CDC14B κατά τη ανακοπή και συνέχιση με βάση το CDC25B.[69] Η μειωτική ανακοπή απαιτεί ανασταλτική φωσφορυλίωση του CDK1 στα υπολείμματα αμινοξέων Thr-14 και Tyr-15 από MYT1 και WEE1[50] καθώς και ρύθμιση των επιπέδων της κυκλίνης Β που διευκολύνεται από το σύμπλοκο που προάγει την αναφάση (anaphase-promoting complex, APC).[69] Το CDK1 ρυθμίζεται από την κυκλίνη Β, της οποίας η σύνθεση κορυφώνεται στο τέλος της μείωσης Ι.[50] Στην ανάφαση Ι, η κυκλίνη Β αποικοδομείται από μια εξαρτώμενη από την ουβικιτίνη οδό.[50] Η σύνθεση της κυκλίνης Β και η ενεργοποίηση του CDK1 ωθούν τα ωοκύτταρα να εισέλθουν στη μετάφαση, ενώ η είσοδος στην ανάφαση ακολουθεί την αποικοδόμηση της κυκλίνης Β με τη μεσολάβηση της ουβικιτίνης, η οποία μειώνει τη δραστηριότητα της CDK1.[50] Η πρωτεόλυση των πρωτεϊνών προσκόλλησης μεταξύ των ομόλογων χρωμοσωμάτων εμπλέκεται στην αναφάση Ι, ενώ η πρωτεόλυση των πρωτεϊνών προσκόλλησης μεταξύ των αδελφών χρωματίδων εμπλέκεται στην ανάφαση II.[50] Η ανακοπή της μείωσης II πραγματοποιείται από τον κυτταροστατικό παράγοντα (by cytostatic factor, CSF), του οποίου τα στοιχεία περιλαμβάνουν την πρωτεΐνη MOS, κινάση πρωτεΐνης ενεργοποιημένη από μιτογόνο (MAPKK/MEK1) και MAPK.[50] Η πρωτεϊνική κινάση p90 (RSK) είναι ένας κρίσιμος στόχος της MAPK και μπορεί να βοηθήσει στον αποκλεισμό της εισόδου στη φάση S μεταξύ της μείωσης Ι και ΙΙ με την επανενεργοποίηση του CDK1.[50] Υπάρχουν ενδείξεις ότι το RSK βοηθά την είσοδο στη μείωση Ι αναστέλλοντας το MYT1, το οποίο ενεργοποιεί το CDK1.[50] Η ανακοπή του ΕΝΥ μπορεί να λάβει χώρα μέσω ρύθμισης του APC ως μέρος του σημείου ελέγχου συναρμολόγησης ατράκτου.[50] Στην εκκολαπτόμενη μαγιά S. cerevisiae, η Clb1 είναι η κύρια μειωτική ρυθμιστική κυκλίνη, αν και τα Clb3 και Clb4 εκφράζονται επίσης κατά τη διάρκεια της μείωσης και ενεργοποιούν μια κινάση που σχετίζεται με το p34cdc28 αμέσως πριν από την πρώτη μειωτική διαίρεση.[71] Ο μεταγραφικός παράγοντας IME1 οδηγεί την είσοδο στη μειωτική φάση S και ρυθμίζεται σύμφωνα με εισροές όπως η διατροφή.[72] Το a1/α2 καταστέλλει έναν καταστολέα του IME1, ξεκινώντας τη μείωση.[72] Έχουν εντοπιστεί πολυάριθμα μειωτικά ρυθμιστικά γονίδια στο S. cerevisiae. Εδώ παρουσιάζονται μερικά. Το IME1 επιτρέπει τη σπορίωση μη a /α διπλοειδών.[73] Το IME2/SME1 επιτρέπει τη σπορίωση όταν υπάρχει άζωτο, υποστηρίζει τον ανασυνδυασμό σε κύτταρα a/α που εκφράζουν το RME1, έναν αναστολέα της μείωσης, και κωδικοποιεί ένα ομόλογο πρωτεϊνικής κινάσης.[73] Το MCK1 (meiosis and centromere regulatory kinase) (μείωση και ρυθμιστική κινάση κεντρομεριδίων) υποστηρίζει επίσης τον ανασυνδυασμό σε κύτταρα a/α που εκφράζουν το RME1 και κωδικοποιεί ένα ομόλογο πρωτεϊνικής κινάσης.[73] Το SME2 επιτρέπει τη σπορίωση όταν υπάρχει αμμωνία ή γλυκόζη.[73] Το "UME1-5" επιτρέπει την έκφραση ορισμένων πρώιμων μειωτικών γονιδίων σε φυτικά, μη a/α κύτταρα.[73] Στη μαγιά σχάσης S. pombe, η κινάση Cdc2 και η κυκλίνη Cig2 ξεκινούν μαζί την προμειωτική φάση S, ενώ η κυκλίνη Cdc13 και ο ενεργοποιητής CDK Cdc25 είναι απαραίτητοι και για τις δύο μειωτικές διαιρέσεις.[74] Ωστόσο, το σύστημα Pat1-Mei2 βρίσκεται στην καρδιά της μειωτικής ρύθμισης του S. pombe. Το Mei2 είναι ο κύριος μειωτικός ρυθμιστής.[74] Κινείται μεταξύ του πυρήνα και του κυτταροπλάσματος και συνεργάζεται με το meiRNA για την προώθηση της μείωσης Ι.[74] Επιπλέον, το Mei2 εμπλέκεται στην έξοδο από τη μίτωση και την επαγωγή της προμειωτικής φάσης S.[74] Το Mei2 μπορεί να αδρανοποιήσει το σύστημα DSR-Mmi1 μέσω της απομόνωσης του Mmi1 για να σταθεροποιήσει την ειδική για τη μείωση έκφραση μεταγραφής.[74] Το Mei2 μπορεί να σταματήσει την ανάπτυξη και να προκαλέσει ανακοπή του G1.[74] Το Pat1 είναι μια πρωτεϊνική κινάση Ser/Thr που φωσφορυλιώνει το Mei2, μια πρωτεΐνη που δεσμεύει το RNA, στα υπολείμματα Ser438 και Thr527[74] Αυτή η φωσφορυλίωση μπορεί να μειώσει τον χρόνο ημιζωής του Mei2 καθιστώντας το πιο πιθανό να καταστραφεί από ένα πρωτεάσωμα που λειτουργεί με E2 Ubc2 και E3 Ubr1.[74] Ο παράγοντας μεταγραφής Mei4 είναι απαραίτητος για την μεταγραφική ενεργοποίηση του cdc25 στη μείωση και το μετάλλαγμα mei4 βιώνει ανακοπή του κυτταρικού κύκλου.[74] Το Mes1 αναστέλλει τον ενεργοποιητή APC/C Slp1 έτσι ώστε η δραστηριότητα Cdc2-Cdc13 MPF να μπορεί να οδηγήσει τη δεύτερη μειωτική διαίρεση.[74] Έχει προταθεί ότι το προϊόν του γονιδίου CEP1 του ζυμομύκητα, που δεσμεύει την κεντρομεριδιακή περιοχή CDE1, μπορεί να παίζει ρόλο στο ζευγάρωμα χρωμοσωμάτων κατά τη διάρκεια της μείωσης-Ι.[75] Ο μειωτικός ανασυνδυασμός διαμεσολαβείται μέσω δίκλωνης θραύσης, η οποία καταλύεται από την πρωτεΐνη Spo11. Επίσης τα Mre11, Sae2 και Exo1 παίζουν ρόλο στη θραύση και τον ανασυνδυασμό. Αφού συμβεί η θραύση, λαμβάνει χώρα ανασυνδυασμός ο οποίος είναι τυπικά ομόλογος. Ο ανασυνδυασμός μπορεί να περάσει είτε μέσω μιας οδού διπλού συνδέσμου Holliday (double Holliday junction, dHJ), είτε μέσω αναδόμησης κλώνου που εξαρτάται από τη σύνθεση (synthesis-dependent strand annealing, SDSA). (Το δεύτερο δίνει προϊόν μη επιχιασμού).[76] Φαινομενικά υπάρχουν επίσης σημεία ελέγχου για τη διαίρεση των μειωτικών κυττάρων. Στο S. pombe, οι πρωτεΐνες Rad, το S. pombe Mek1 (με τομέα κινάσης FHA), το Cdc25, το Cdc2 και άγνωστος παράγοντας θεωρείται ότι σχηματίζουν ένα σημείο ελέγχου.[77] Στην ωογένεση των σπονδυλωτών, που διατηρείται από τον κυτταροστατικό παράγοντα (cytostatic factor, CSF) παίζει ρόλο στη μετάβαση στη μείωση II.[75]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ «4.1: Meiosis». Biology LibreTexts (στα Αγγλικά). 1 Οκτωβρίου 2019. Ανακτήθηκε στις 29 Μαΐου 2021.
- ↑ «Definition of Reduction division». MedicineNet (στα Αγγλικά). Ανακτήθηκε στις 29 Μαΐου 2021.
- ↑ 3,0 3,1 Freeman S (2011). Biological Science (6th έκδοση). Hoboken, NY: Pearson. σελ. 210.
- ↑ «To err (meiotically) is human: the genesis of human aneuploidy». Nature Reviews Genetics 2 (4): 280–91. April 2001. doi:. PMID 11283700.
- ↑ Letunic I, Bork P (2006). «Interactive Tree of Life». Αρχειοθετήθηκε από το πρωτότυπο στις 29 Ιανουαρίου 2018. Ανακτήθηκε στις 23 Ιουλίου 2011.
- ↑ «Evolutionary origin of recombination during meiosis». BioScience 60 (7): 498–505. 2010. doi:.
- ↑ «Sex is not a solution for reproduction: the libertine bubble theory». BioEssays 33 (6): 419–22. June 2011. doi:. PMID 21472739.
- ↑ Carter JS (27 Οκτωβρίου 2012). «Mitosis». University of Cincinnati. Αρχειοθετήθηκε από το πρωτότυπο στις 27 Οκτωβρίου 2012. Ανακτήθηκε στις 9 Φεβρουαρίου 2018.
- ↑ «Regulation of meiotic gene expression in plants». Frontiers in Plant Science 5: 413. August 2014. doi:. PMID 25202317.
- ↑ «Unified single-cell analysis of testis gene regulation and pathology in five mouse strains». eLife 8: e43966. June 2019. doi:. PMID 31237565.
- ↑ «High-resolution view of the yeast meiotic program revealed by ribosome profiling». Science 335 (6068): 552–7. February 2012. doi:. PMID 22194413. Bibcode: 2012Sci...335..552B.
- ↑ Freeman 2005, σελίδες 244–45
- ↑ «Genetic analysis of chromosome pairing, recombination, and cell cycle control during first meiotic prophase in mammals». Endocrine Reviews 27 (4): 398–426. June 2006. doi:. PMID 16543383.
- ↑ «Meiotic Recombination: The Essence of Heredity». Cold Spring Harbor Perspectives in Biology 7 (12): a016618. October 2015. doi:. PMID 26511629.
- ↑ 15,0 15,1 15,2 Freeman 2005, σελίδες 249–250
- ↑ 16,0 16,1 16,2 16,3 16,4 16,5 Snustad DP, Simmons MJ (Δεκεμβρίου 2008). Principles of Genetics (5th έκδοση). Wiley. ISBN 978-0-470-38825-9.
- ↑ Krebs JE, Goldstein ES, Kilpatrick ST (Νοεμβρίου 2009). Lewin's Genes X
 (10th έκδοση). Jones & Barlett Learning. ISBN 978-0-7637-6632-0.
(10th έκδοση). Jones & Barlett Learning. ISBN 978-0-7637-6632-0.
- ↑ 18,0 18,1 18,2 18,3 «Recombination, Pairing, and Synapsis of Homologs during Meiosis». Cold Spring Harbor Perspectives in Biology 7 (6): a016626. May 2015. doi:. PMID 25986558.
- ↑ «Regulating double-stranded DNA break repair towards crossover or non-crossover during mammalian meiosis». Chromosome Research 15 (5): 565–77. July 2007. doi:. PMID 17674146.
- ↑ «Meiosis, genetic recombination, and sexual reproduction». Nature Education 1 (1): 174. 2008. https://www.nature.com/scitable/topicpage/meiosis-genetic-recombination-and-sexual-reproduction-210/.
- ↑ «Meiotic chromosomes in motion: a perspective from Mus musculus and Caenorhabditis elegans». Chromosoma 128 (3): 317–330. September 2019. doi:. PMID 30877366.
- ↑ «Gene conversion: mechanisms, evolution and human disease». Nature Reviews. Genetics 8 (10): 762–75. October 2007. doi:. PMID 17846636.
- ↑ «Meiosis: the chromosomal foundation of reproduction». Biology of Reproduction 99 (1): 112–126. July 2018. doi:. PMID 29385397.
- ↑ Nussbaum RL, McInnes RR, Willard HF, Hamosh A (21 Μαΐου 2015). Thompson & Thompson genetics in medicine (8th έκδοση). Elsevier. σελ. 19. ISBN 978-1437706963. OCLC 908336124.
- ↑ «Self-organization of MTOCs replaces centrosome function during acentrosomal spindle assembly in live mouse oocytes». Cell 130 (3): 484–98. August 2007. doi:. PMID 17693257.
- ↑ «Human oocytes. Error-prone chromosome-mediated spindle assembly favors chromosome segregation defects in human oocytes». Science 348 (6239): 1143–7. June 2015. doi:. PMID 26045437. Bibcode: 2015Sci...348.1143H.
- ↑ «Complete kinetochore tracking reveals error-prone homologous chromosome biorientation in mammalian oocytes». Cell 146 (4): 568–81. August 2011. doi:. PMID 21854982.
- ↑ 28,0 28,1 Pierce, Benjamin (2009). «Chromosomes and Cell Reproduction». Genetics: A Conceptual Approach, Third Edition. W.H. FREEMAN AND CO. (ISBN 9780716779285) P. 32
- ↑ «Structure and functions of stable intercellular bridges formed by incomplete cytokinesis during development». Communicative & Integrative Biology 4 (1): 1–9. January 2011. doi:. PMID 21509167.
- ↑ «BioCoach Activity: Concept 11: Meiosis II: Metaphase II». The Biology Place. Pearson. Αρχειοθετήθηκε από το πρωτότυπο στις 28 Φεβρουαρίου 2018. Ανακτήθηκε στις 10 Φεβρουαρίου 2018.
- ↑ «A phylogenomic inventory of meiotic genes; evidence for sex in Giardia and an early eukaryotic origin of meiosis». Curr Biol 15 (2): 185–91. January 2005. doi:. PMID 15668177. Bibcode: 2005CBio...15..185R.
- ↑ «Population genetics provides evidence for recombination in Giardia». Curr Biol 17 (22): 1984–8. November 2007. doi:. PMID 17980591. Bibcode: 2007CBio...17.1984C.
- ↑ «Demonstration of genetic exchange during cyclical development of Leishmania in the sand fly vector». Science 324 (5924): 265–8. April 2009. doi:. PMID 19359589. Bibcode: 2009Sci...324..265A.
- ↑ «The chastity of amoebae: re-evaluating evidence for sex in amoeboid organisms». Proc Biol Sci 278 (1715): 2081–90. July 2011. doi:. PMID 21429931.
- ↑ «The first sexual lineage and the relevance of facultative sex». J Mol Evol 48 (6): 779–83. June 1999. doi:. PMID 10229582. Bibcode: 1999JMolE..48..779D.
- ↑ «On the origins of the Mendelian laws». The Journal of Heredity 75 (1): 67–9. 1984-01-01. doi:. PMID 6368675.
- ↑ «Inherited differences in crossing over and gene conversion frequencies between wild strains of Sordaria fimicola from "Evolution Canyon"». Genetics 159 (4): 1573–93. December 2001. doi:. PMID 11779798.
- ↑ «A molecular cell biology toolkit for the study of meiosis in the silkworm Bombyx mori». G3 (Bethesda) 13 (5). May 2023. doi:. PMID 36911915.
- ↑ «The transformation of the Synaptonemal Complex into the 'elimination chromatin' in Bombyx mori oocytes». Chromosoma 60 (3): 205–21. April 1977. doi:. PMID 870294.
- ↑ 40,0 40,1 40,2 «Why is meiosis arrested?». Journal of Theoretical Biology 194 (2): 275–87. September 1998. doi:. PMID 9778439. Bibcode: 1998JThBi.194..275M.
- ↑ 41,0 41,1 41,2 «Oocytes can efficiently repair DNA double-strand breaks to restore genetic integrity and protect offspring health». Proceedings of the National Academy of Sciences of the United States of America 117 (21): 11513–11522. May 2020. doi:. PMID 32381741. Bibcode: 2020PNAS..11711513S.
- ↑ «Genetic damage, mutation, and the evolution of sex». Science 229 (4719): 1277–81. September 1985. doi:. PMID 3898363. Bibcode: 1985Sci...229.1277B.
- ↑ Bernstein H, Hopf FA, Michod RE (1987). «The Molecular Basis of the Evolution of Sex». Molecular Genetics of Development. Advances in Genetics. 24. σελίδες 323–70. doi:10.1016/s0065-2660(08)60012-7. ISBN 978-0-12-017624-3. PMID 3324702.
- ↑ «The interacting pathways for prevention and repair of oxidative DNA damage». Mutat Res 531 (1–2): 231–51. October 2003. doi:. PMID 14637258. Bibcode: 2003MRFMM.531..231S.
- ↑ «Sexual reproduction as a response to H2O2 damage in Schizosaccharomyces pombe». J Bacteriol 171 (4): 1893–7. April 1989. doi:. PMID 2703462.
- ↑ «Heat shock elicits production of sexual inducer in Volvox». Science 231 (4733): 51–4. January 1986. doi:. PMID 3941891. Bibcode: 1986Sci...231...51K.
- ↑ «Sex as a response to oxidative stress: a twofold increase in cellular reactive oxygen species activates sex genes». Proc Biol Sci 271 (1548): 1591–6. August 2004. doi:. PMID 15306305.
- ↑ South GR, Whittick A (8 Ιουλίου 2009). An Introduction to Phycology. Wiley. ISBN 978-1-4443-1420-5.
- ↑ Bidlack JE, Jansky S, Stern KR (2011). Stern's Introductory Plant Biology. McGraw Hill. σελίδες 214–29. ISBN 978-0-07-304052-3. OCLC 320895017.
- ↑ 50,00 50,01 50,02 50,03 50,04 50,05 50,06 50,07 50,08 50,09 50,10 50,11 50,12 50,13 Eppig, John J.; Viveiros, Maria M.; Bivens, Carrie Marin; De la fuente, Rabindranath (2004-01-01), Leung, PETER C. K.; Adashi, Eli Y., επιμ., Chapter 7 - Regulation of Mammalian Oocyte Maturation, San Diego: Academic Press, σελ. 113–129, ISBN 978-0-12-444562-8, https://www.sciencedirect.com/science/article/abs/pii/B9780124445628500082, ανακτήθηκε στις 2024-12-15
- ↑ «Positioning to get out of meiosis: the asymmetry of division». Human Reproduction Update 17 (1): 68–75. 2010. doi:. PMID 20833637.
- ↑ «The contradictory information on the distribution of non-disjunction and pre-division in female gametes». Human Reproduction 21 (11): 2739–42. November 2006. doi:. PMID 16982661.
- ↑ «Germ cell-intrinsic and -extrinsic factors govern meiotic initiation in mouse embryos». Science 322 (5908): 1685–7. December 2008. doi:. PMID 19074348. Bibcode: 2008Sci...322.1685L.
- ↑ «Nanos2 suppresses meiosis and promotes male germ cell differentiation». Genes & Development 22 (4): 430–5. February 2008. doi:. PMID 18281459.
- ↑ 55,0 55,1 «Two functionally redundant sources of retinoic acid secure spermatogonia differentiation in the seminiferous epithelium». Development 146 (1): dev170225. January 2019. doi:. PMID 30487180.
- ↑ «Retinoid signaling determines germ cell fate in mice». Science 312 (5773): 596–600. April 2006. doi:. PMID 16574820. Bibcode: 2006Sci...312..596B.
- ↑ «Sex-specific timing of meiotic initiation is regulated by Cyp26b1 independent of retinoic acid signalling». Nature Communications 2 (1): 151. January 2011. doi:. PMID 21224842. Bibcode: 2011NatCo...2..151K.
- ↑ 58,0 58,1 «Meiosis in protists: recent advances and persisting problems». European Journal of Protistology 31: 1–7. 1995. doi:.
- ↑ «Genome and Gene Structure». Emery and Rimoin's Principles and Practice of Medical Genetics and Genomics: 53–77. 2019-01-01. doi:. ISBN 978-0-12-812537-3.
- ↑ «Meiosis». Encyclopedia of Biological Chemistry: 17–23. 2013-01-01. doi:. ISBN 978-0-12-378631-9.
- ↑ «Effect of maternal age on autosomal trisomies». Annals of Human Genetics 44 (1): 29–36. July 1980. doi:. PMID 7198887.
- ↑ «Age-related decrease of meiotic cohesins in human oocytes». PLOS ONE 9 (5): e96710. May 2014. doi:. PMID 24806359. Bibcode: 2014PLoSO...996710T.
- ↑ «How Cells Divide». PBS. Public Broadcasting Service. Αρχειοθετήθηκε από το πρωτότυπο στις 1 Νοεμβρίου 2012. Ανακτήθηκε στις 6 Δεκεμβρίου 2012.
- ↑ «Meiosis in protists. Some structural and physiological aspects of meiosis in algae, fungi, and protozoa». Bacteriological Reviews 40 (1): 190–240. March 1976. doi:. PMID 773364.
- ↑ Schorderet-Slatkine, Sabine; Drury, Kenneth C. (1973-10-01). «Progesterone induced maturation in oocytes of Xenopus laevis. Appearance of a 'maturation promoting factor' in enucleated oocytes». Cell Differentiation 2 (4): 247–254. doi:. ISSN 0045-6039. PMID 4799790. https://www.sciencedirect.com/science/article/abs/pii/0045603973900134.
- ↑ 66,0 66,1 Gerhart, J.; Wu, M.; Kirschner, M. (April 1984). «Cell cycle dynamics of an M-phase-specific cytoplasmic factor in Xenopus laevis oocytes and eggs». The Journal of Cell Biology 98 (4): 1247–1255. doi:. ISSN 0021-9525. PMID 6425302.
- ↑ Dekel, Nava (July 1995). «Molecular control of meiosis». Trends in Endocrinology & Metabolism 6 (5): 165–169. doi:. ISSN 1043-2760. PMID 18406698. https://www.cell.com/trends/endocrinology-metabolism/abstract/1043-2760(95)00079-W.
- ↑ 68,0 68,1 68,2 68,3 68,4 68,5 68,6 Zhang, Meijia (2017), Chian, Ri-Cheng; Nargund, Geeta; Huang, Jack Y. J., επιμ., A New Understanding on the Regulation of Oocyte Meiotic Prophase Arrest and Resumption, Cham: Springer International Publishing, σελ. 59–74, doi:, ISBN 978-3-319-53454-1, https://link.springer.com/chapter/10.1007/978-3-319-53454-1_3, ανακτήθηκε στις 2024-12-15
- ↑ 69,0 69,1 69,2 69,3 69,4 69,5 69,6 69,7 Solc, Petr; Schultz, Richard M.; Motlik, Jan (2010-09-01). «Prophase I arrest and progression to metaphase I in mouse oocytes: comparison of resumption of meiosis and recovery from G2-arrest in somatic cells». Molecular Human Reproduction 16 (9): 654–664. doi:. ISSN 1360-9947. PMID 20453035. PMC 2930517. https://academic.oup.com/molehr/article-abstract/16/9/654/1044737?redirectedFrom=fulltext.
- ↑ 70,0 70,1 70,2 70,3 70,4 70,5 70,6 70,7 70,8 Jamnongjit, Michelle; Hammes, Stephen (2005). «Oocyte Maturation: The Coming of Age of a Germ Cell». Seminars in Reproductive Medicine 23 (3): 234–241. doi:. PMID 16059829.
- ↑ Grandin, Nathalie; Reed, Steven I. (1993-04-01). «Differential Function and Expression of Saccharomyces cerevisiae B-type Cyclins in Mitosis and Meiosis». Molecular and Cellular Biology 13 (4): 2113–2125. doi:. PMID 8455600.
- ↑ 72,0 72,1 «Molecular regulation of the mitosis/meiosis decision in multicellular organisms». Cold Spring Harbor Perspectives in Biology 3 (8): a002683. August 2011. doi:. PMID 21646377.
- ↑ 73,0 73,1 73,2 73,3 73,4 Mitchell, A. P. (1994). «Control of meiotic gene expression in Saccharomyces cerevisiae» (στα αγγλικά). Microbiological Reviews 58 (1): 56–70. doi:. PMID 8177171.
- ↑ 74,00 74,01 74,02 74,03 74,04 74,05 74,06 74,07 74,08 74,09 Harigaya, Yuriko; Yamamoto, Masayuki (2007-07-01). «Molecular mechanisms underlying the mitosis–meiosis decision» (στα αγγλικά). Chromosome Research 15 (5): 523–537. doi:. ISSN 1573-6849. PMID 17674143. https://link.springer.com/article/10.1007/s10577-007-1151-0.
- ↑ 75,0 75,1 «Regulatory mechanisms in meiosis». Current Opinion in Cell Biology 5 (2): 219–25. April 1993. doi:. PMID 8389567.
- ↑ «Mechanism and regulation of meiotic recombination initiation». Cold Spring Harbor Perspectives in Biology 7 (1): a016634. October 2014. doi:. PMID 25324213.
- ↑ «Regulation of meiotic progression by the meiosis-specific checkpoint kinase Mek1 in fission yeast». Journal of Cell Science 116 (Pt 2): 259–71. January 2003. doi:. PMID 12482912.
Αναφερόμενα κείμενα
[Επεξεργασία | επεξεργασία κώδικα]- Freeman S (2005). Biological Science
 (3rd έκδοση). Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 978-0-13-140941-5.
(3rd έκδοση). Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 978-0-13-140941-5.


