Υδροσελήνιο
| Υδροσελήνιο | |||
|---|---|---|---|
| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Υδροσελήνιο | ||
| Άλλες ονομασίες | Σελάνιο Υδρίδιο του σεληνίου Υδροσεληνικό οξύ Υδροσεληνίδιο Σεληνιούχο υδρογόνο Σεληνίδιο του υδρογόνου | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | H2Se | ||
| Μοριακή μάζα | 80,98 ± 0,03 amu | ||
| Αριθμός CAS | 7783-07-5 | ||
| SMILES | [SeH2] | ||
| InChI | 1S/H2Se/h1H2 | ||
| Αριθμός EINECS | 231-978-9 | ||
| Αριθμός RTECS | X1050000 | ||
| Αριθμός UN | 2202 | ||
| PubChem CID | 533 | ||
| ChemSpider ID | 518 | ||
| Δομή | |||
| Μήκος δεσμού | 146 pm | ||
| Είδος δεσμού | ομοιοπολικός | ||
| Πόλωση δεσμού | 3,5% (H+-Se-) | ||
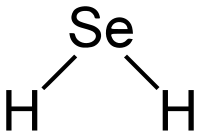
| Γωνία δεσμού | 91° | ||
| Μοριακή γεωμετρία | επίπεδη γωνιακή | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -65,73 °C | ||
| Σημείο βρασμού | -41,25 °C | ||
| Κρίσιμη θερμοκρασία | 138 °C | ||
| Κρίσιμη πίεση | 87,994 atm | ||
| Πυκνότητα | 1.974 kg/m³ (υγρό, −41,4 °C) 1.970 kg/m³ (υγρό, στο σημείο βρασμού 3,66 kg/m³ (0 °C, 101,3 kPa) 3,553 kg/m³ | ||
| Διαλυτότητα στο νερό |
9,7-9,8 kg/m³ (20 °C) 7 kg/m³ | ||
| Διαλυτότητα σε άλλους διαλύτες |
διαλυτό στο διθειάνθρακα (CS2) | ||
| Δείκτης διάθλασης , nD |
1,412 (16,85 °C) | ||
| Τάση ατμών | 0,91 MPa (20 °C) 9,5 atm (21 °C) | ||
| Χημικές ιδιότητες | |||
| pKa | 3,89 11,0 | ||
| Επικινδυνότητα | |||
   
| |||
| Πολύ εύφλεκτο (F+) Πολύ τοξικό (T+) Επικίνδυνο για το περιβάλλον(N) Ερεθιστικό (Xi) | |||
| Φράσεις κινδύνου | 23/25, 33, 50/53 | ||
| Φράσεις ασφαλείας | 1/2, 20/21, 28, 45, 60, 61 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το υδροσελήνιο[1] είναι ανόργανη δυαδική ομοιοπολική χημική ένωση, που περιέχει υδρογόνο και σελήνιο, με μοριακό τύπο H2Se. Είναι το απλούστερο και πρακτικά το μοναδικό (σχετικά σταθερό) υδρίδιο του σεληνίου. Το χημικά καθαρό υδροσελήνιο, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο εύφλεκτο αέριο. Είναι ακόμη μια από τις πιο τοξικές ενώσεις του σεληνίου[2] με όριο έκθεσης μόλις 0,05 ppm, εντός χρονικού διαστήματος οκτώ (8) ωρών[3][4]. Αυτή η ένωση έχει πολύ ερεθιστική οσμή χραίνας σε αποσύνθεση, αλλά και κλούβιων αβγών, όταν βρίσκεαι σε υψηλότερες συγκεντρώσεις.
Δομή και ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Το μόριο του υδροσεληνίου υιοθετεί μια γωνιακή δομή, με μια δεσμική γωνία των 91°.
| Δεσμοί[5][6] | |||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός | Ισχύς δεσμού |
|---|---|---|---|---|---|
| Se-H | σ | 4sp³-1s | 146 pm | 3,5% Se- H+ | 276 kJ/mol |
| Γωνίες | |||||
| HSeH | 91° | ||||
| Στατιστικό ηλεκτρικό φορτίο[7] | |||||
| Se | -0,07 | ||||
| H | +0,035 | ||||
Σε συνέπεια μ' αυτήν τη δομή, οι τρεις απορροφήσεις που παρατηρούνται σε φάσματα υπερύθρου του υδροσεληνίου είναι 2358, 2345 και 1034 cm-1.
Οι ιδιότητες του υδροσεληνίου είναι παρόμοιες με αυτές του υδροθείου, αλλά το υδροσελήνιο είναι πιο όξινο, με pKa1 = 3,89 (έναντι 6,89) και pKa2 = 11,0 (έναντι 11,96). Εξαιτίας της αυξημένης οξύτητάς του, το υδροσελήνιο είναι και πιο υδατοδιαλυτό, 7 kg/m³ (έναντι 4 kg/m³).
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιοχηχανικά παράγεται με ολική σύνθεση, δηλαδή με επίδραση αέριου υδρογόνου σε στοιχειακό σελήνιο, σε θερμοκρασία πάνω από 300 °C.[8]:
Ένας αριθμός από μεθόδους παραγωγής υδροσεληνίου έχουν αναφερθεί, κατάλληλες για μεγάλης ή μικρής κλίμακας παραγωγή του. Σε εργαστηριακή κλίμακα χρησιμοποιείται συνήθως η υδρόλυση σεληνιούχου αργιλίου (Al2Se3). Μια παρόμοια αντίδραση περιλαμβάνει όξινη υδρόλυση σεληνιούχου σιδήρου (FeSe)[9]:
Σύμφωνα με τη μέθοδο Σονοντά (Sonoda), το υδροσελήνιο παράγεται με αντίδραση ύδατος, μονοξειδίου του άνθρακα και στοιχειακού σεληνίου, παρουσία τριαιθυλαμίνης (Et3N)[10]:
Το υδροσελήνιο μπορεί να παραγγελθεί σε ειδικούς κυλίνδρους.
Αντιδράσεις και εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Το υδροσελήνιο θερμολύεται στους 180 °C:
Το υδροσελήνιο υφίσταται διάσταση ως ασθενές οξύ, όταν διαλύεται σε νερό:
(pKa1 = 3,89)
(pKa2 = 11,0)
Η διάσπαση υδροσεληνίου με διοξείδιο του θείου (SO2) χρησιμοποιείται για την παραγωγή ιδιαίτερα καθαρού στοιχειακού σεληνίου:
Ακόμη, το υδροσελήνιο χρησιμοποιείται συχνά για τη σύνθεση σεληνιούχων ενώσεων, ανόργανων και οργανικών. Δίνει αντιδράσεις προσθήκης σε αλκένια, παράγοντας σεληνόλες (RSeH). Π.χ. για αλκένια τύπου RCH=CH2, έχουμε:
Ένα άλλο παράδειγμα χρήσης υδροσεληνίου είναι η σύνθεση σεληνουριών από νιτρίλια.[11]:
Τέλος, το υδροσελήνιο χρησιμοποιείται για την παραγωγή ημιαγωγικών προϊόντων με σελήνιο.
Το υδροσελήνιο χρησιμοποιήθηκε ειδικότερα στην εισαγωγή ατόμων σεληνίων για πρόσμειξη σε ημιγωγικά υλικά.
Ασφάλεια
[Επεξεργασία | επεξεργασία κώδικα]Το αέριο υδροσελήνιο είναι βλαβερό, όντας μια από τις πιο τοξικές ενώσεις του σεληνίου και πολύ τοξικότερο από το υδρόθειο.
Ωστόσο, έχει τόσο έντονη και απαίσια οσμή, που απομακρύνει τα υποψήφια θύματά του, ακόμη και σε χαμηλές συγκεντρώσεις του, εφόσον φυσικά μπορούν (να απομακρυνθούν). Η αίσθηση της οσμής του αρχίζει (συνήθως) από τη συγκέντρωση των 50 ppb (50 μg/m³). Όταν η συγκέντρωση υδροσεληνίου φθάσει τα 300 ppb (300 μg/m³), το αέριο αυτό αρχίζει να ερεθίζει τα αναπνευστικά όργανα. Από τα 1,5 ppm (1,5 mg/m³), η οσμή του υδροσεληνίου γίνεται ήδη αφόρητη. Σε ακόμη υψηλότερες συγκεντρώσεις, ακόμη και η έκθεση για λιγότερο από 1 λεπτό προσβάλλει τα μάτια, τις βλεννογόνες μεμβράνες, και προκαλεί βλάβες στο αναπνευστικό σύστημα, προκαλώντας συμπτώματα παρόμοια με αυτά του κρυολογήματος, που διαρκούν τουλάχιστον για αρκετές ημέρες μετά το συμβάν της έκθεσης στο αέριο. Παρά την πολύ υψηλή τοξικότητά του, δεν έχουν αναφερθεί ακόμη θάνατοι ανθρώπων εξαιτίας του. Θεωρείται ότι αυτό συμβαίνει εξαιτίας της τάσης του υδροσεληνίου να οξειδώνεται, σχηματίζοντας ερυθρό σελήνιο (αλλότροπο), στις βλεννογόνες μεμβράνες. Το στοιχειακό σελήνιο είναι λιγότερο τοξικό από ότι οι ενώσεις του[3], και μάλλον αυτή η οξείδωση σε λιγότερο τοξικό χημικό είδος σώζει (προς το παρόν τουλάχιστον) τη ζωή των υποψήφιων θυμάτων του.
Έχει όριο έκθεσης μόλις 0,05 ppm εντός χρονικής περιόδου οκτώ (8) ωρών. Στη Γερμανία το μέγιστο επιτρεπόμενο όριο συγκέντρωσης υδροσεληνίου στο πόσιμο νερό είναι 8 μg/l, ενώ στις ΗΠΑ 10 μg/l.[8][12].
Παρατηρήσεις, υποσημειώσεις και αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Για εναλλακτικές ονομασίες και συμβολισμούς δείτε τον πίνακα πληροφοριών.
- ↑ http://www.epa.gov/ttnatw01/hlthef/selenium.html, US Environmental Protection Agency, Air Toxins website
- ↑ 3,0 3,1 http://www.cdc.gov/niosh/idlh/7783075.html, Documentation of Immediately Dangerous to Life or Health Concentrations: Hydrogen Selenide, The National Institute for Occupational Safety and Health
- ↑ http://www.cdc.gov/niosh/docs/81-123/pdfs/0336.pdf Occupational Health Guideline for Hydrogen Selenide, The National Institute for Occupational Safety and Health, 1978
- ↑ Τα δεδομένα προέρχονται από τους πίνακες δεδομένων των στοιχείων άνθρακα, πυριτίου και υδρογόνου και τις πηγές«Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και «Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982»
- ↑ «chem.tamu.edu» (PDF). Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 28 Ιανουαρίου 2018.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ 8,0 8,1 Bernd E. Langner "Selenium and Selenium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. .
- ↑ Féher, F. In "Handbook of Preparative Inorganic Chemistry"; Brauer, E., Ed.; Academic: New York, 1963; 1, p 418.
- ↑ Sonoda, N.; Kondo K.; Nagano, K.; Kambe, N.; Morimoto, F. Angewandte Chemie, International Edition English 1980, vol. 19, page 308
- ↑ V.I. Cohen "A Convenient Synthesis of Mono-, N,N′-Di-, and Trisubstituted Selenoureas from Methyl Carbamimidothioates (S-Methylpseudothioureas)" Synthesis, 1980, 60-3 (1980).
- ↑ http://www.osha.gov/dts/chemicalsampling/data/CH_246700.html Αρχειοθετήθηκε 2012-05-16 στο Wayback Machine., OSHA GENERAL INDUSTRY PEL: 0.05 ppm, 0.2 mg/m3 ,OSHA CONSTRUCTION INDUSTRY PEL: 0.05 ppm, 0.2 mg/m3 TWA











