Νιτραιθένιο
| Νιτραιθένιο | |||
|---|---|---|---|
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Νιτραιθένιο | ||
| Άλλες ονομασίες | Νιτραιθυλένιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H3NO2 | ||
| Μοριακή μάζα | 73,051 amu | ||
| Σύντομος συντακτικός τύπος |
CH2=CHNO2 | ||
| Συντομογραφίες | ViNO2 | ||
| Αριθμός CAS | 3638-64-0 | ||
| SMILES | C=C[N+]([O-])=O | ||
| InChI | 1S/C2H3NO2/c1-2-3(4)5/h2H,1H2 | ||
| PubChem CID | 14436 | ||
| ChemSpider ID | 69627 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | >17 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −55 °C | ||
| Σημείο βρασμού | 98,5 °C | ||
| Πυκνότητα | 1.073 kg/m3 | ||
| Διαλυτότητα στο νερό |
78,9 kg/m3 (20 °C) | ||
| Τάση ατμών | 45,8 mmHg | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
23,2 °C | ||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
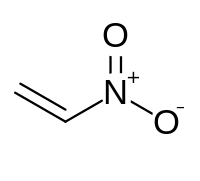
Το νιτραιθένιο ή νιτραιθυλένιο είναι μια υγρή (στις συνηθισμένες συνθήκες, T = 25 °C, P = 1 atm) οργανική ένωση με χημικός τύπο C2H3NO2. Είναι το απλούστερο νιτροαλκένιο, δηλαδή μια άκυκλη ένωση με ένα διπλό δεσμό και μια νιτροομάδα (-NO2). Το νιτραιθένιο εξυπηρετεί ως ένα χρήσιμο ενδιάμεσο κατά την παραγωγή μιας ποικιλίας άλλων χημικών προϊόντων.
Ισομερή θέσης
[Επεξεργασία | επεξεργασία κώδικα]Με βάση το χημικό του τύπο, C2H3NO2, έχει τουλάχιστον τα ακόλουθα ισομερή θέσης (όχι όλα σταθερά):
- Αιθενονιτρονικό οξύ με σύντομο συντακτικό τύπο: CH2=C=NOOH (ταυτομεές του νιτραιθενίου).
- Νιτρώδης βινυλεστέρας με σύντομο συντακτικό τύπο: CH2=CHONO (ο βινυλεστέρας του νιτρώδους οξέος).
- 1-νιτρωδοαιθενόλη με σύντομο συντακτικό τύπο: CH2=C(NO)OH .
- 2-νιτρωδοαιθενόλη με σύντομο συντακτικό τύπο: ONCH=CHOH (σε δύο (2) γεωμετρικά ισομερή).
- Υδροξυαμινοαιθινόλη με σύντομο συντακτικό τύπο: HOC ≡ CNHOH.
- Αιθινοδιυδροξυλαμίνη με σύντομο συντακτικό τύπο: Η C≡ CN(OH)2.
- Ιμιναιθενοδιόλη με σύντομο συντακτικό τύπο: HN = C = C(OH)2.
- Υδροξυϊμινοαιθενυδροξυλιμίνη με σύντομο συντακτικό τύπο: HOCH=C=NOH.
- Ιμιναιθανοδιόλη με σύντομο συντακτικό τύπο: HN = CHCH(OH)2.
- Διυδροξυαιθανονιτρίλιο με σύντομο συντακτικό τύπο: (ΗΟ)2CHCN.
- Υδροξυαμιναιθενόνη με σύντομο συντακτικό τύπο: ΗΟNHCH=CO.
- Αμινυδροξυαιθενόνη με σύντομο συντακτικό τύπο: HOCH(NH)=CO.
- Ιμιναιθανικό οξύ με σύντομο συντακτικό τύπο: HN=CHCOOH.
- Μεθυλενοκαρβιμικό οξύ με σύντομο συντακτικό τύπο: CH2=NCOOH.
- Μεθανικός ιμινομεθυλεστέρας με σύντομο συντακτικό τύπο: HCOOCH=NH.
- Μεθανικός μεθυλενιμινεστέρας με σύντομο συντακτικό τύπο: HCOON=CH2.
- Φορμυλομεθαναμίδιο με σύντομο συντακτικό τύπο: HCOCONH2.
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «νιτραιθένιο» θεωρεί ότι η ένωση είναι υποκατεστημένο αιθένιο, δηλαδή αιθένιο, ένα άτομο υδρογόνου του οποίου, έχει αντικατασταθεί από μια νιτροομάδα (-NO2).
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]
Βιομηχανική
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθάνιο παράγεται βιομηχανικά σε δύο (2) στάδια:
1. Με επίδραση νιτρομεθάνιου σε μεθανάλη (ή και σε ένα ολιγομερές της, όπως την παραφορμαλδεΰδη). Το αρχικό αποτέλεσμα αυτής της αντίδρασης είναι η παραγωγή της 2-νιτραιθανόλης:
2. Στη συνέχεια, με επίδραση θειικού οξέος στην 2-νιτραιθανόλη αποσπάται μονομοριακά νερό, με μηχανισμό E2, παράγοντας νιτραιθένιο[1]:
Εναλλακτικές μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους αργύρου σε βινυλαλογονίδια
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους αργύρου σε βινυλαλογονίδιο, παράγεται νιτραιθένιο[2][3]:
Από 2-χλωροπροπενικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους νατρίου σε 2-χλωροπροπενικό νάτριο, παράγεται νιτραιθένιο[4]:
Από 1-αλο-2-νιτραιθάνιο
[Επεξεργασία | επεξεργασία κώδικα]Με απόσπαση υδραλογόνου από 1-αλο-2-νιτραιθάνιο παράγεται νιτραιθένιο[5]:
Γενικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθένιο έχει μια διπολική ροπή που παράγεται από την προσέλκυση ηλεκτρονικού νέφους από τη νιτρομάδα που περιέχεται στο μόριο. Έτσι είναι διαλυτό στο νερό αλλά και σε μη πολικούς διαλύτες. Το νιτραιθένιο είναι εξαιρετικά δραστικό, ακόμη και σε χαμηλές θερμοκρασίες. Σύντομα αυτοδιασπάται σε θερμοκρασία δωματίου (20 °C). Σε αντιδιαστολή όμως με την αναφερόμενη αστάθειά του, βρέθηκε ότι είναι σχετικά σταθερό αν διαλυθεί στ βενζόιο, τουλάχιστον επί έξι (6) μήνες, αν αποθηκευθεί σε θερμοκρασία -10 °C[6].
Χημική συμπεριφορά και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθένιο έχει ένα μόριο με έλλειμμα ηλεκτρονίων. Ως αποτέλεσμα, το νιτραιθένιο δρα ως ηλεκτρονιόφιλο στις αντιδράσεις. Είναι ικανό να αντιδρά αυτόρμητα ακόμη και σε θερμοκρασίες κάτω από -100 °C, δίνοντας συχνά εξώθερμες αντιδράαεις. Τα πιο συνηθισμένα είδη αντιδράσεων αυτής της ένωσης είναι οι αντιδράσεις κυκλοπροσθήκης, οι αντιδράσεις προσθήκης ελευθέρων ριζών και οι αντιδράσεις πυρηννόφιλης προσθήκης[7].
Κυκλοπροσθήκες
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθένιο μπορεί να δρα ως πηγή 2π ηλεκτρονίων σε μια κυκλοπροσθήκγη τύπου 4+2. Η νιτρομάδα εξυπηρετεί ως ομάδα προσέλκυσης ηλεκτρονικού νέφους, γεγονός που κάνει την ένωση μια καλή υποψήφια ως ένα «διενόφιλο». Π.χ. αντιδρά γρήγορα με το κυκλοπενταδιένιο, το σπειροεπταδιένιο, και τα παράγωγά τους, σε αντιδράσεις κυκλοπροσθήκης 4+2[6]. Ένα απλούστερο παράδειγμα είναι η αντίδραση νιτραιθενίου με 1,3-κυκλοβουταδιένιο, που δίνει 4-νιτροκυκλεξένιο[8]:
4-νιτροκυκλεξένιο
Ακόμη, το νιταιθένιο μπορεί να αντιδρά αρχικά με έναν «χειρόμοφρο» βινυλαιθέρα, και μετά να δίνει κυκλοπροσθήκη 3+2 με ένα διενόφιλο με έλλειμμα ηλεκτρονίου, όπως το διμεθυλοφουμαρικό οξύ. Οι αντιδράσεις αυτές είναι σχεδόν αυθόρμητες ακόμη και στους -78 °C[9]. Ένα απλούστερο παράδειγμα είναι η αντίδραση νιτραιθενίου με αιθένιο, που δίνει 3-μεθυλενο-N-υδροξυ-1,2-οξαζολιδίνη:
3-μεθυλενο-N-υδροξυ-1,2-οξαζολιδίνη
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Yamaoka, H.; Williams, F.; Hayashi, K. Radiation-Induced Polymerization of Nitroethylene. Trans. Faraday Soc., 1967, 63, 376-381. DOI: 10.1039/TF9676300376
- ↑ Η χρήση νιτρώδους καλίου (ΚΝΟ2) δίνει τον ισομερή νιτρώδη βινυλεστέρα (CH3CH2ONO).
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 244, §10.3.1. και Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991, σελ. 111, §8.1.
- ↑ Whitmore, F. C.; Whitmore, M. G. (1941), «Nitromethane», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv1p0401; Coll. Vol. 1: 401
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ 6,0 6,1 Ranganathan, D.; Rao, C. B.; Ranganathan, S.; Mehrotra, A.K; Iyengar, R. Nitroethylene: A Stable, Clean, and Reactive Agent for Organic Synthesis. J. Org. Chem. 1980, 45, 1185-1189.
- ↑ Singleton, Daniel A. Nitroethylene. Publication. College Station: n.p., 2008. Wiley Online Library. Web. 18 Oct. 2012.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.
- ↑ Denmark, S. E., Hurd A. R. Tandem [4+2]/[3+2] Cycloadditions with Nitroethylene. J. Org. Chem., 1998, 63(9), 3045-3050.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, Οργανική Χημεία, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982


![{\displaystyle \mathrm {O_{2}NCH_{2}CH_{2}OH{\xrightarrow[{H_{2}SO_{4}}]{\triangle }}CH_{2}=CHNO_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1bf38772cef440078b0b6ce32485333436f5f61f)


![{\displaystyle \mathrm {O_{2}NCH_{2}CH_{2}X+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{2}=CHNO_{2}+NaX+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f55c124d78666328a3ff91bd4e0a75b765378a07)

