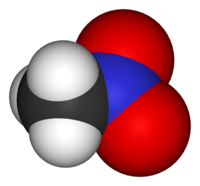
Νιτρομεθάνιο
| Νιτρομεθάνιο | |||
|---|---|---|---|

| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Νιτρομεθάνιο | ||
| Άλλες ονομασίες | Νιτροκαρβόλιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | CH3NO2 | ||
| Μοριακή μάζα | 61,04amu | ||
| Σύντομος συντακτικός τύπος |
CH3NO2 | ||
| Συντομογραφίες | MeNO2 | ||
| Αριθμός CAS | 75-52-5 | ||
| SMILES | C[N+]([O-])=O | ||
| Αριθμός RTECS | PA9800000 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 12 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −29 °C | ||
| Σημείο βρασμού | 100-103 °C | ||
| Πυκνότητα | 1.137,1 kg/m3 | ||
| Διαλυτότητα στο νερό |
100 kg/m3 | ||
| Ιξώδες | 0,61 mPa·s (25 °C) | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| pKa | 10,2 | ||
| Βαθμός οκτανίου | 750 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
35 °C | ||
| Επικινδυνότητα | |||
| Φράσεις κινδύνου | R5 R10 R22 | ||
| Φράσεις ασφαλείας | S41 | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το νιτρομεθάνιο ή νιτροκαρβόλιο είναι οργανική ένωση με σύντομο συντακτικό τύπο CH3NO2. Είναι η απλούστερη νιτροένωση. Πρόκειται για ένα άχρωμο, ελαφρά κολλώδες, πολύ πολικό υγρό (στις συνηθισμένες συνθήκες, T = 25 °C, P = 1 atm), που χρησιμοποιείται ως διαλύτης σε ποικιλία βιομηχανικών εφαρμογών, όπως εκχύλιση, ως μέσο για διάφορες αντιδράσεις και ως καθαριστικό συσκευών. Χρησιμοποιείται ευρύτατα ως ενδιάμεση ύλη σε οργανικές συνθέσεις, στην παραγωγή φαρμακευτικών, ζιζανιοκτόνων, εκρηκτικών, ινών και επιστρώσεων. Χρησιμοποιείται επίσης ως (κορυφαίο) πρόσθετο καυσίμου αγώνων αυτοκινήτων (με αριθμό οκτανίου 750) και τηλεκατευθυνόμενων μοντέλων κλίμακας (μινιατούρες) αυτοκινήτων, σκαφών και αεροσκαφών.
Ισομερή θέσης
[Επεξεργασία | επεξεργασία κώδικα]Με βάση το χημικό του τύπο, CH3NO2, έχει τα ακόλουθα 12 ισομερή θέσης:
- Μεθανονιτρονικό οξύ με σύντομο συντακτικό τύπο: CH2=NOOH (ταυτομεές του νιτρομεθανίου).
- Νιτρώδης μεθυλεστέρας με σύντομο συντακτικό τύπο: CH3ONO (ο μεθυλεστέρας του νιτρώδους οξέος).
- Υδροξιμινομεθανόλη με σύντομο συντακτικό τύπο: HON=CHOH.
- Νιτρωδομεθανόλη με σύντομο συντακτικό τύπο: ONCH2OH.
- Μεθανοϋδροξαμίδιο με σύντομο συντακτικό τύπο: HCONHOH
- Καρβαμικό οξύ με σύντομο συντακτικό τύπο: H2NCOOH.
- 1,2,3-διοξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - 1,3,2-διοξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - 3-υδροξυ-1,2-οξαζιριδίνη με σύντομο συντακτικό τύπο:
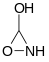 .
. - Ν-υδροξυ-1,2-οξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - Αμινοδιοξιράνιο με σύντομο συντακτικό τύπο:
 .
. - N-μεθυλοδιοξαζιριδίνη με σύντομο συντακτικό τύπο:
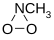 .
.
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «νιτρομεθάνιο» θεωρεί ότι η ένωση είναι υποκατεστημένο μεθάνιο, δηλαδή μεθάνιο, ένα άτομο υδρογόνου του οποίου, έχει αντικατασταθεί από μια νιτροομάδα (-NO2).
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιομηχανική
[Επεξεργασία | επεξεργασία κώδικα]Το νιτρομεθάνιο παράγεται βιομηχανικά με επίδραση νιτρικού οξέος σε προπάνιο στους 350–450 °C. Αυτή είναι μια εξωθερμική χημική αντίδραση, που παράγει βιομηχανικά ένα μίγμα από τα ακόλουθα νιτροαλκάνια: νιτρομεθάνιο, νιτραιθάνιο, 1-νιτροπροπάνιο και 2-νιτροπροπάνιο. Η αντίδραση προχωρά με αντίδραση ελευθέρων ριζών, που περιλαμβάνουν και τις αλκοξυ- (RO●) ελεύθερες ρίζες, που παράγονται με ομόλυση των αντίστοιχων νιτρωδών εστέρων. Αυτές οι αλκοξυ- ελεύθερες ρίζες είναι υπεύθυνες για αντιδράσεις διάσπασης δεσμών C-C, γεγονός που εξηγεί το σχηματισμό και νιτροαλκανίων με μικρότερο αριθμό ατόμων άνθρακα από το προπάνιο[1].
Εναλλακτικές μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Με νίτρωση μεθανίου
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρικού οξέος σε μεθάνιο, στην αέρια κατάσταση, παράγεται νιτρομεθάνιο[2]:
Με επίδραση νιτρώδους αργύρου σε μεθυλαλογονίδια
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους αργύρου σε μεθυλαλογονίδιο, παράγεται νιτρομεθάνιο[3][4]:
Με οξείδωση μεθαναμίνης
[Επεξεργασία | επεξεργασία κώδικα]Με οξείδωση μεθαναμίνης από υπεροξείδιο του υδρογόνου (H2O2) ή καρβονικό υπεροξύ (RCO3H), παράγεται νιτρομεθάνιο[5]:
ή
Από χλωραιθανικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους νατρίου σε χλωραιθανικό νάτριο, παράγεται νιτρομεθάνιο[6]:
Χημική συμπεριφορά
[Επεξεργασία | επεξεργασία κώδικα]Ταυτομερείωση
[Επεξεργασία | επεξεργασία κώδικα]Το νιτρομεθάνιο έχει μία ταυτομερή μορφή, το «μεθανονιτρονικό οξύ» (CH2=NOOH)[7]:
Όξινη συμπεριφορά
[Επεξεργασία | επεξεργασία κώδικα]Το νιτρομεθάνιο έχει όξινη συμπεριφορά, οπότε αντιδρά με βάσεις[8]:
Συμπύκνωση Μίχαελ
[Επεξεργασία | επεξεργασία κώδικα]Το νιτρομεθάνιο αντιδρά σε βασικό περιβάλλον με καρβονλικές ενώσεις, δίνοντας τη γνωστή συμπύκνωση Μίχαελ. Π.χ. με μεθανάλη δίνει 2-νιτρο-1-αιθανόλη[9]:
Αναγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το νιτρομεθάνιο ανάγεται με τη χρήση σιδήρου και υδροχλωρικού οξέος ή λιθιοαργιλιοϋδρίδιου, σχηματίζοντας μεθαναμίνη[10]:
ή
Επίδραση νιτρώδους οξέος
[Επεξεργασία | επεξεργασία κώδικα]Το νιτρομεθάνιο με επίδραση νιτρώδους οξέος δίνει μεθανονιτρολικό οξύ[11]:
Επίδραση πυκνών οξέων
[Επεξεργασία | επεξεργασία κώδικα]Το νιτρομεθάνιο με επίδραση πυκνού θειικού οξέος ή υδροχλωρικού οξέος δίνει μεθανικό οξύ και υδροξυλαμίνη[12]:
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Η κύρια χρήση του νιτρομεθανίου είναι ως ένας σταθεροποιητής για χλωριομένους διαλύτες, που χρησιμοποιούνται σε στεγνοκαθαριστήρια, επεξεργασία ημιαγωγών και απογράσσωση. Ακόμη, χρησιμοποιήθηκε πολύ επιτυχημένα ως ένας διαλύτης, ή παράγοντας που βοηθά τη διάλυση, για ακρυλικά μονομερή, όπως τα κυανακρυλικά (πιο γνωστά στο κοινό ως «σούπερ-κόλλα», super glue)[1].
Παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Σε οργανικές συνθέσεις το νιτρομεθάνιο παίρνει μέρος ως μέσο παροχής ομάδας ενός (1) ατόμου άνθρακα.[13][14]. Η οξύτητά του επιτρέπει την αποπρωτονίωση, επιτρέποντας αντιδράσεις ανάλογες με αυτές των καρβονυλικών ενώσεων. Έτσι, με χρήση βάσης ως καταλύτη, το νιτρομεθάνιο δίνει αντιδράσεις 1,2-προσθήκης σε αλδεΰδες, που εξειδικευμένα ονομάζπνται «νιτραλδολικες αντιδράσεις». Κάποια σημαντικά παράγωγα του νιτρομεθανίου συμπεριλαμβάνουν τα εντομοκτόνα χλωροπικρίνη (CCl3NO2 και τρι(υδροξυμεθυλο)νιτρομεθάνιο (HOCH2)3CNO2), πιο γνωστό με την εμπειρική ονομασία «τρις».
Σε πιο εξιδικευμένες οργανικές συνθέσεις, το νιτρομεθάνιο εξυπηρετή ωε ένας «δότης κατά Michael», με 1,4-προσθήκη σε α,β-ακόρεστες καρβονυλικές ενώσεις, σύμφωνα με την ονομαζόμενη αντίδραση Μισέλ (Michael reaction).
Ως καύσιμο
[Επεξεργασία | επεξεργασία κώδικα]Το νιτρομεθάνιο χρησιμοποιείται ως καύσιμο αγώνων μηχανοκινήτων, πυραύλων και τηλεκατευθυνόμενων μοντέλων αυτοκινήτων και αεροσκαφών. Όταν χρησιμοποιείται για τη χρήση αυτή, συνήθως αναφέρεται η παρουσία του στα σχετικά προϊόντα με την ονομασία «νίτρο» (nitro). Το γεγονός ότι η ίδια η ένωση εμπεριέχει οξυγόνο, το κάνει να μπορεί να καεί, ακόμη και σε μίγματα φτωχότερα σε ατμοσφαιρικό οξυγόνο:
Συγκρίνοντας το νιτρομεθάνιο με τη βενζίνη ως καύσιμο, η ποσότητα αέρα που απαιτείται για να καούν 0,45 χιλιόγραμμα βενζίνγης είναι 6,7 χιλιόγραμμα, ενώ για την καύση ίδιας ποσότητας νιτρομεθανίου απαιτούνται μόλις 0,77 χιλιόγραμμα αέρα. Επειδή δε οι κύλινδροι ενός κινητήρα εσωτερικής καύσης μπορούν να περιέχουν μια περιορισμένη ποσότητα αέρα ανά ανάφλεξη, αυτό σημαίνει ότι σε κάθε (στροφή του κινητήρα και) ανάφλεξη μπορεί να καεί 8,7 φορές μεγαλύτερη ποσότητα νιτρομεθανίου, απ' ότι βενζίνης. Βέβαια, το νιτρομεθάνιο έχει μικρότερη ενεργειακή πυκνότητα, αφού αποδίδει μόλις 11,3 MJ/kg, έναντι 42–44 MJ/kg της βενζίνης. Επειδή όμως σε κάθε ανάφλρξη στους κυλίνδρους καίγεται μεγαλύτερη ποσότητα νιτρομεθανίου απ' ότι βενζίνης, η τελική ανάλυση δίνει ότι το νιτρομεθάνιο παράγει τελικά 2,3 φορές περισσότερη ισχύ όταν καίγεται με μια δεδομένη ποσότητα οξυγόνου, σε σύγκριση πάντα με τη βενζίνη.
Το νιτρομεθάνιο είναι ακόμη «μονοπροωθητικό», δηλαδή μπορεί να καεί ακόμη και χωρίς την παρουσία εξωτερικής πηγής οξυγονου:
Το νιτρομεθάνιο έχει μια στρωτή ταχύτητα καύσης, που μετρήθηκε 0,5 m/s, κάπως υψηλότερη απ' αυτήν της βενζίνης, κάνοντάς το ιδανικό καύσιμο για χρήση σε υψηλόστροφους κινητήρες. Επίσης παράχει κάπως υψηλότερη θερμοκρασία καύσης, της τάξης των 2.400 °C. Ακόμη, η υψηλή θερμότητα εξαέρωσής του, 0,56 MJ/kg, σε συνδυασμό με τη (σχετικά) υψηλή ρευστότητα του καυσίμου προσφέρει σημαντική ψύξη του εισερχόμενου φορτίου καύσης (περίπου τη διπλάσια σε σύγκριση με τη μεθανόλη), οδηγώντας σε λογικά χαμηλότερες θερμοκρασίες λειτουργίας του κινητήρα.
Όταν χρησιμοποιούνται «πλούσια» μίγματα καυσίμου - αέρα παράγονται μονοξείδιο του άνθρακα και υδρογόνο, ως προϊόντα καύσης. Αυτά τα αέρια συχνά αναφλέγονται λίγο μετά την εξάτμιση του οχήματος, με κάπως θεαματικά αποτελέσματα. Αυτό βέβαια είναι αρκετά συνηθισμένο κατά την ανάφλεξη πλουσίων μιγμάτων καυσίμων - αέρα, γενικότερα. Τα πολύ πλούσια μίγματα είναι απαραίτητα για να μειώνεται η θερμοκρασία στα θερμά τμήματα των θαλάμων καύσης, ώστε να αποφεύγεται η ανεπιθύμητη προανάφλεξη και προεκτόνωση του καυσίμου (τα γνωστά «πειράκια»). Οι λειτουργικές λεπτομέρειες εξαρτώνται από τα ειδικά χαρακτηριστικά κάθε μίγμτος καυσίμου - οξειδωτικού και κινητήρα.
Μια μικρή ποσότητα υδραζίνης αναμιγνύεται μερικές φορές με το νιτρομεθάνιο, για να αυξήσει ακόμη περισσότερο την απόδοση ισχύος. Το νιτρομεθάνιο σχηματίζει με την υδραζίνη ένα εκρηκτικό άλας που είναι επίσης μονοπροωθητικό. Η χρήση αυτού του ασταθούς μίγματος είναι ιδιαίτερα επικίνδυνη, γι' αυτό και απαγορεύεται η χρήση του ως καύσιμο μοντέλων.
Τα καύσιμα που παρέχονται για τα μοντέλα περιέχουν συνήθως μίγματα μεθανόλης - νιτρομεθανίου - ορυκτελαίου (0% - 65% σε νιτρομεθάνιο, αν και σπάνια ξεπερνάται το 30%. Το ποσοστό συμετοχής του ορυκτελαίου είναι 10-20%). Ωστόσο σε αγώνες αυτοκινήτων χρησιμοποιήθηκαν και μίγματα 90% νιτρομεθανίου και 10% μεθανόλης. Ακόμη και μικρή ποσότητα νιτρομεθανίου τείνει να αυξάνει αξιοσημείωτα την ισχύ που παράγει ο κινητήρας.
Εκρηκτικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Το νιτρομεθάνιο δεν ήταν γνωστό ότι είναι ένα ισχυρό εκρηκτικό, μέχρι που έγινε ένα σιδηροδρομικό δυστύχημα, την 1η Ιουνίου του 1958, οπότε ένα βυτιοφόρο βαγόνι που μετέφερε νιτρομεθάνιο ανατινάχτηκε[15]. Μετά από αυτό έγιναν σχετικά πειράματα, από τα οποία έγινε γνωστό ότι το νιτρομεθάνιο είναι ένα πιο ενεργητικό ισχυρό εκρηκτικό σε σύγκριση με το 2,4,6-τρινιτροτολουόλιο (TNT), αν και το TNT έχει μεγαλύτερη ταχύτητα εκτόνωσης και είναι πιο «θραυστικό». Και τα δυο εκρηκτικά είναι (σχετικά) φτωχά σε οξυγόνο κι έτσι ενισχύεται η εκρηκτική ικανότητά τους αν αναμιχθούν με ένα οξειδωτικό, όπως το νιτρικό αμμώνιο. Το καθαρό νιτρομεθάνιο είναι ένα (σχετικά) μη ευαίσθητο εκρηκτικό, με VoD = 6.400 m/s, αλλά ακόμη κι έτσι, είναι χρήσιμο να προστίθενται ειδικοί αναστολείς, ώστε να μειώνεται ο κίνδυνος έκρηξης κατά τη χρήση του. Η έκρηξη στο βαγόνι θεωρήθηκε ότι ήταν απλά αποτέλεσμα αδιαβατικής συμπίεσης, δηλαδή ένας συνηθισμένος κίνδυνος για υγρά εκρηκτικά. Αυτό συμβαίνει όταν ένα τέτοιο υγρό εμπεριέχει φυσαλίδες αέρα που συμπιέζονται (κάποια στιγμή) και υπερθερμένοντα, οπότε ξαφνικά αυξάνεται απότομα η πίεση που ασκούν. Θεωρήθηκε ότι ένας χειριστής έκλεισε απότομα μια βαλβίδα, δημιουργώντας, χωρίς βέβαια να το θελει, ένα κύμα πίεσης.
Αν είναι επιθυμητό να ευασθητοποιηθεί, ως εκρηκτικό, αυτό είναι δυνατό με την προσθήκη μιας βάσης, ώστε να αυξηθεί το pH. Ακόμη, μπορεί να προσθεθεί νιτρικό αμμώνιο, το οποίο χρησιμοποιείται ως οξειδωτικό, για να δημιουργήσει ένα εκρηκτικό μίγμα γνωστό ως ANNM (Ammonium Nitate NitroMethane). Ένα παράδειγμα τέτοιας χρήσης έγινε κατά τη βομβιστική επίθεση της Οκλαχόμα Σίτι. Είναι επίσης δυνατή η ανάμιξη νιτρομεθανίου με πυκνό νιτρικό οξύ, σχηματίζοντας ένα εκρηκτικό μίγμα με παρόμοια ισχύ κα ευαισθησία με τη νιτρογλυκερίνη.
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 Markofsky, S. B. (2000). «Nitro Compounds, Aliphatic». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 244, §10.3.2.
- ↑ Η χρήση νιτρώδους καλίου (ΚΝΟ2) δίνει τον ισομερή νιτρώδη μεθυλεστέρα (CH3ONO).
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 244, §10.3.1. και Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991, σελ. 111, §8.1.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 246, §10.5.7α.
- ↑ Whitmore, F. C.; Whitmore, M. G. (1941), «Nitromethane», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv1p0401; Coll. Vol. 1: 401
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.1.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.2.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.4α.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.5.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.6.
- ↑ Dauben, H. J. Jr.; Ringold, H. J.; Wade, R. H.; Pearson, D. L.; Anderson, A. G. Jr.; de Boer, T. J.; Backer, H. J. (1963), «Cycloheptanone», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv4p0221; Coll. Vol. 4: 221
- ↑ Noland, W. E. (1963), «2-Nitroethanol», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv5p0833; Coll. Vol. 4: 833
- ↑ Interstate Commerce Commission. «Accident Near Mt. Pulaski, ILL» (PDF). Ex Parte No 213. Αρχειοθετήθηκε από το πρωτότυπο (pdf) στις 7 Ιανουαρίου 2009. Ανακτήθηκε στις 11 Φεβρουαρίου 2013.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, Οργανική Χημεία, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982













![{\displaystyle \mathrm {CH_{3}NO_{2}{\xrightarrow[{{\acute {\eta }}\;\pi .\;HCl,\;\triangle }]{\pi .\;H_{2}SO_{4},\;\triangle }}HCOOH+NH_{2}OH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b8c35bf5fd9cc0e12e8edd3ea7c1af4a6d7bda5b)

