Νιτραιθάνιο
| Νιτραιθάνιο | |||
|---|---|---|---|

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Νιτραιθάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H5NO2 | ||
| Μοριακή μάζα | 75,07 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH2NO2 | ||
| Συντομογραφίες | EtNO2 | ||
| Αριθμός CAS | 79-24-3 | ||
| SMILES | CC[N+]([O-])=O | ||
| Αριθμός RTECS | KI5600000 | ||
| Αριθμός UN | UN 2842 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 62 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −90 °C | ||
| Σημείο βρασμού | 112-116 °C | ||
| Πυκνότητα | 1.054 kg/m3 | ||
| Διαλυτότητα στο νερό |
46 kg/m3 (20 °C) | ||
| Ιξώδες | 0,677 Pa·s (20 °C) | ||
| Εμφάνιση | Άχρωμο υγρό | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
28 °C | ||
| Επικινδυνότητα | |||
| Φράσεις κινδύνου | R5 R10 R22 | ||
| Φράσεις ασφαλείας | S41 | ||
| LD50 | 1100 mg/kg | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το νιτραιθάνιο είναι μια οργανική ένωση που έχει σύντομο συντακτικό τύπο CH3CH2NO2. Είναι μια νιτροένωση, όπως το νιτρομεθάνιο. Στις συνηθισμένες συνθήκες (T = 25 °C, P = 1 atm) rίναι ένα ελαιώδες υγρό. Το καθαρό νιτροαιθάνιο είναι άχρωμο και έχει μια φρουτένια οσμή.
Ισομερή θέσης
[Επεξεργασία | επεξεργασία κώδικα]Με βάση το χημικό του τύπο, C2H5NO2, έχει τα ακόλουθα 62 ισομερή θέσης:
- Αιθανονιτρονικό οξύ με σύντομο συντακτικό τύπο: CH3CH=NOOH (ταυτομεές του νιτραιθανίου).
- Νιτρώδης αιθυλεστέρας με σύντομο συντακτικό τύπο: CH3CH2ONO (ο αιθυλεστέρας του νιτρώδους οξέος).
- 1-νιτρωδοαιθανόλη με σύντομο συντακτικό τύπο: CH3CH(NO)OH (σε δύο (2) οπτικά ισομερή).
- 2-νιτρωδοαιθανόλη με σύντομο συντακτικό τύπο: ONCH2CH2OH.
- Αμινο-1,1-αιθενοδιόλη με σύντομο συντακτικό τύπο: H2NCH=C(OH)2.
- Αμινο-1,2-αιθενοδιόλη με σύντομο συντακτικό τύπο: HOCH=C(NH2)OH (σε δύο (2) γεωμετρικά ισομερή).
- 1-υδροξυαμινοαιθενόλη με σύντομο συντακτικό τύπο: CH2=C(OH)NHOH.
- 2-υδροξυαμινοαιθενόλη με σύντομο συντακτικό τύπο: HOCH=CHNHOH (σε δύο (2) γεωμετρικά ισομερή).
- Αιθενοδιυδροξυλαμίνη με σύντομο συντακτικό τύπο: CH2=CHN(OH)2.
- Ιμινο-1,1-αιθανοδιόλη με σύντομο συντακτικό τύπο: HN=CH2CH(OH)2.
- Ιμινο-1,2-αιθανοδιόλη με σύντομο συντακτικό τύπο: HOCH2C(=NH)OH.
- 1-υδροξιμινοαιθανόλη με σύντομο συντακτικό τύπο: CH3C(OH)=NOH.
- 2-υδροξιμινοαιθανόλη με σύντομο συντακτικό τύπο: HOCH2CH=NOH.
- Μεθυλιμινομεθανοδιόλη με σύντομο συντακτικό τύπο: CH3N=C(OH)2.
- Ν-υδροξυμεθυλιμινομεθανόλη με σύντομο συντακτικό τύπο: HOCH2N=CHOH.
- Μεθοξυϊμινομεθανόλη με σύντομο συντακτικό τύπο: HN=C(OCH3)OH.
- Μεθυλεναμινοξυμεθανόλη με σύντομο συντακτικό τύπο: HOCH2ON=CH2.
- 1-μεθοξυϊμινομεθανόλη με σύντομο συντακτικό τύπο: CH3OC(=NH)OH.
- N-μεθοξυϊμινομεθανόλη με σύντομο συντακτικό τύπο: CH3ON=CHOH.
- (Ιμινομεθοξυ)μεθανόλη με σύντομο συντακτικό τύπο: HN=CHOCH2OH.
- Μεθοξυμεθανοϋδροξυλιμίνη με σύντομο συντακτικό τύπο: CH3OCΗ=NOH.
- Αμινοϋδροξυαιθανάλη με σύντομο συντακτικό τύπο: HOCH(NH2)CHO (σε δύο (2) οπτικά ισομερή).
- (Υδροξυαμινο)αιθανάλη με σύντομο συντακτικό τύπο: HONHCH2CHO.
- Γλυκίνη με σύντομο συντακτικό τύπο: H2NCH2COOH.
- Μεθυλοκαρβαμικό οξύ με σύντομο συντακτικό τύπο: CH3ΝΗCOOH.
- Καρβαμικός μεθυλεστέρας με σύντομο συντακτικό τύπο: H2NCOΟCH3.
- Μεθανικός αμινομεθυλεστέρας με σύντομο συντακτικό τύπο: HCOΟCH2NH2.
- Μεθανικός μεθυλαμινεστέρας με σύντομο συντακτικό τύπο: HCOΟNHCH2.
- 1-υδροξυαιθαναμίδιο με σύντομο συντακτικό τύπο: HOCH2CONH2.
- N-υδροξυαιθαναμίδιο με σύντομο συντακτικό τύπο: CH3CONHOH.
- (Υδροξυμεθυλο)μεθαναμίδιο με σύντομο συντακτικό τύπο: HCONHCH2OH.
- Μεθυλυδροξυμεθαναμίδιο με σύντομο συντακτικό τύπο: HCON(OH)CH3.
- 1,2,3-διοξαζολιδίνη με σύντομο συντακτικό τύπο:
 .
. - 1,2,4-διοξαζολιδίνη με σύντομο συντακτικό τύπο:
 .
. - 1,3,2-διοξαζολιδίνη με σύντομο συντακτικό τύπο:
 .
. - 1,4,2-διοξαζολιδίνη με σύντομο συντακτικό τύπο:
 .
. - 3-αμινο-1,2-διοξετάνιο με σύντομο συντακτικό τύπο:
 .
. - 2-αμινο-1,3-διοξετάνιο με σύντομο συντακτικό τύπο:
 .
. - 3-υδροξυ-1,2-οξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - N-υδροξυ-1,2-οξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - 2-υδροξυ-1,3-οξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - N-υδροξυ-1,3-οξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - 4-μεθυλο-1,2,3-διοξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - N-μεθυλο-1,2,3-διοξαζετιδίνη με σύντομο συντακτικό τύπο:
 .
. - 4-μεθυλο-1,3,2-διοξαζετιδίνη με σύντομο συντακτικό τύπο:
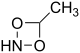 .
. - N-μεθυλο-1,3,3-διοξαζετιδίνη με σύντομο συντακτικό τύπο:
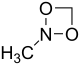 .
. - 2-αμινο-2-υδροξιράνιο με σύντομο συντακτικό τύπο:
 .
. - 3-αμινο-2-υδροξιράνιο με σύντομο συντακτικό τύπο:
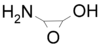 .
. - Υδροξυαμινοξιράνιο με σύντομο συντακτικό τύπο:
 .
. - 2,2-διυδροξυαζιριδίνη με σύντομο συντακτικό τύπο:
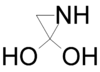 .
. - 2,3-διυδροξυαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - 2,N-διυδροξυαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - 3-μεθυλο-3-υδροξυοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - N-μεθυλο-3-υδροξυοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - 3-μεθυλο-N-υδροξυοξαζιριδίνη με σύντομο συντακτικό τύπο:
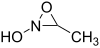 .
. - 3-μεθοξυοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - N-μεθοξυοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - 3-υδροξυμεθυλοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - Ν-υδροξυμεθυλοξαζιριδίνη με σύντομο συντακτικό τύπο:
 .
. - Αμινομεθυλοδιοξιράνιο με σύντομο συντακτικό τύπο:
 .
. - Μεθυλαμινοδιοξιράνιο με σύντομο συντακτικό τύπο:
 .
. - Αιθυλοδιοξαζιριδίνη με σύντομο συντακτικό τύπο:
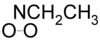 .
.
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «νιτραιθάνιο» θεωρεί ότι η ένωση είναι υποκατεστημένο αιθάνιο, δηλαδή αιθάνιο, ένα άτομο υδρογόνου του οποίου, έχει αντικατασταθεί από μια νιτροομάδα (-NO2).
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιομηχανική
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθάνιο παράγεται βιομηχανικά με επίδραση νιτρικού οξέος σε προπάνιο στους 350–450 °C. Αυτή είναι μια εξωθερμική χημική αντίδραση, που παράγει βιομηχανικά ένα μίγμα από τα ακόλουθα νιτροαλκάνια: νιτρομεθάνιο, νιτραιθάνιο, 1-νιτροπροπάνιο και 2-νιτροπροπάνιο. Η αντίδραση προχωρά με αντίδραση ελευθέρων ριζών, που περιλαμβάνουν και τις αλκοξυ- (RO●) ελεύθερες ρίζες, που παράγονται με ομόλυση των αντίστοιχων νιτρωδών εστέρων. Αυτές οι αλκοξυ- ελεύθερες ρίζες είναι υπεύθυνες για αντιδράσεις διάσπασης δεσμών C-C, γεγονός που εξηγεί το σχηματισμό και νιτροαλκανίων με μικρότερο αριθμό ατόμων άνθρακα από το προπάνιο[1].
Εναλλακτικές μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Με νίτρωση αιθανίου
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρικού οξέος σε αιθάνιο, στην αέρια κατάσταση, παράγεται νιτραιθάάνιο[2]:
Με επίδραση νιτρώδους αργύρου σε αιθυλαλογονίδια
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους αργύρου σε αιθυλαλογονίδιο, παράγεται νιτραιθάνιο[3][4]:
Με οξείδωση αιθαναμίνης
[Επεξεργασία | επεξεργασία κώδικα]Με οξείδωση μεθαναμίνης από υπεροξείδιο του υδρογόνου (H2O2) ή καρβονικό υπεροξύ (RCO3H), παράγεται νιτραιθάνιο[5]:
ή
Από 2-χλωροπροπανικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση νιτρώδους νατρίου σε 2-χλωροπροπανικό νάτριο, παράγεται νιτραιθάνιο[6]:
Χημική συμπεριφορά
[Επεξεργασία | επεξεργασία κώδικα]Ταυτομερείωση
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθάνιο έχει μία ταυτομερή μορφή, το «αιθανονιτρονικό οξύ» (CH3CH=NOOH)[7]:
Όξινη συμπεριφορά
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθάνιο έχει όξινη συμπεριφορά, οπότε αντιδρά με βάσεις[8]:
Συμπύκνωση Μίχαελ
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθάνιο αντιδρά σε βασικό περιβάλλον με καρβονλικές ενώσεις, δίνοντας τη γνωστή συμπύκνωση Μίχαελ. Π.χ. με μεθανάλη δίνει 2-νιτρο-1-προπανόλη[9]:
Αναγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθάνιο ανάγεται με τη χρήση σιδήρου και υδροχλωρικού οξέος ή λιθιοαργιλιοϋδρίδιου, σχηματίζοντας αιθαναμίνη[10]:
ή
Επίδραση νιτρώδους οξέος
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθάνιο με επίδραση νιτρώδους οξέος δίνει αιθανονιτρολικό οξύ[11]:
Επίδραση πυκνών οξέων
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθάνιο με επίδραση πυκνού θειικού οξέος ή υδροχλωρικού οξέος δίνει αιθανικό οξύ και υδροξυλαμίνη[12]:
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Μέσω αντιδράσεων συμπύκνωσης, όπως η αντίδραση Χενρύ, το νιτραιθάνιο μετατρέπεται σε αρκετές ενώσεις με εμπορικό ενδιαφέρον. Παραδείγματα:
- Συμπύκνωση με την 3,4-διμεθοξυβενζαλδεΰδη αποδίδει το αντιυπερτασικό φάρμακο (δραστική ουσία) μεθυλντόπα.
- Συμπύκνωση με τη βενζαδεΰδη αποδίδει την ένωση 2-νιτρο-1-φαινυλο-1-προπένιο.
- Συμπυκνώνεται με δυο μοριακά ισοδύναμα μεθανάλης, δίνοντας, μετά από υδρογόνωση, την ένωση 2-αμινο-2-μεθυλο-1,3-προπανοδιόλη, που με τη σειρά του συμπυκνώνεται με ελαϊκό οξύ, δίνοντας οξαζολίνη, η οποία πρωτονιώνεται δίνοντας ένα κατιονικό επιφανειοδραστικό[1].
Όπως και κάποιες άλλες οργανικές νιτροενώσεις, το νιτραιθάνιο χρησιμοπποιήθηκε επίσης ως ένα προσθετικό καυσίμων, αλλά και ως πρόδρομη ουσία για την παραγωγή εκρηκτικών.
Το νιταιθάνιο είναι ένας χρήσιμος διαλύτης για πολυμερή, όπως το πολυστυρένιο και ιδιαίτερα χρήσιμο για τη διάλυση κυανακρυλικών κολλών. Σε εξειδικευμένες εφαρμογές, χρησιμοποιήθηκε ως ένα συστατικό σε διαλυτικό απομάκρυνσης βερνικιών νυχιών και γενικά σε σπρέυ κολλητικών υλικών οροφής.
Τοξικότητα
[Επεξεργασία | επεξεργασία κώδικα]Το νιτραιθάνιο είναι ύποπτο ότι προκαλεί ζημία στο γεννετικό σύστημα και ότι είναι βλαβερό για το νευρικό σύστημα. Οι τυπικοί δείκτες τοξικότητας TLV/TWA και STEL είναι 100 και 150 ppm, αντιστοίχως. Στο άνθρωπος\ανθρώπινο δέρμα προκαλεί δερματίτιδα. Σε μελέτες που έγιναν σε πειραματόζωα, η έκθεσή τους σε νιτραιθάνιο παρατηρήθηκε ότι προκαλεί δακρύρροια, δύσπνοια, πνευμονικούς ρόγχους, οίδημα, βλάβες στο ήπαρ και στα νεφρά, και νάρκωση[13]. Καταγράφηκαν περιπτώσεις, στις οποίες παιδιά έχουν δηλητηριαστεί από κατά λάθος κατάποση αφαιρετικού βερνικιού νυχιών που περιείχε νιταιθάνιο[14].
Η θανατηφόρα συγκέντρωση (εκφρασμένη σε LD50 για ποντίκια), για το νιτρομεθάνιο, αναφέρθηκε σε 1100 mg/kg[15].
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ 1,0 1,1 Markofsky, S. B. (2000). «Nitro Compounds, Aliphatic». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 244, §10.3.2.
- ↑ Η χρήση νιτρώδους καλίου (ΚΝΟ2) δίνει τον ισομερή νιτρώδη αιθυλεστέρα (CH3CH2ONO).
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 244, §10.3.1. και Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991, σελ. 111, §8.1.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 246, §10.5.7α.
- ↑ Whitmore, F. C.; Whitmore, M. G. (1941), «Nitromethane», Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv1p0401; Coll. Vol. 1: 401
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.1.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.2.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.3.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.4α.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.5.
- ↑ «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 247, §10.6.6.
- ↑ «"Chemical Sampling Information Nitroethane." Retrieved February 9, 2007, from the website of the US Occupational Safety & Health Administration». Αρχειοθετήθηκε από το πρωτότυπο στις 31 Ιουλίου 2017. Ανακτήθηκε στις 15 Φεβρουαρίου 2013.
- ↑ Hornfeldt CS, Rabe WH (1994). «Nitroethane poisoning from an artificial fingernail remover». J. Toxicol. Clin. Toxicol. 32 (3): 321–4. PMID 8007041.
- ↑ MSDS for nitroethane (revised October 3, 2005), as reported by Fisher Scientific.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, Οργανική Χημεία, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982

































![{\displaystyle \mathrm {CH_{3}CH_{2}NO_{2}{\xrightarrow[{{\acute {\eta }}\;\pi .\;HCl,\;\triangle }]{\pi .\;H_{2}SO_{4},\;\triangle }}CH_{3}COOH+NH_{2}OH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/938cd3e055337f45780f77fa7360696cdbfdf778)