2-μεθυλοπυριδίνη
| 2-μεθυλοπυριδίνη | |||
|---|---|---|---|

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 2-μεθυλοπυριδίνη | ||
| Άλλες ονομασίες | 2-μεθυλαζίνη[1] 2-μεθυλαζαβενζόλιο[2] 2-πικολίνη | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C6H7N | ||
| Μοριακή μάζα | 93,12 amu | ||
| Αριθμός CAS | 109-06-8 | ||
| SMILES | Cc1ccccn1 | ||
| InChI | 1S/C6H7N/c1-6-4-2-3-5-7-6/h2-5H,1H3 | ||
| PubChem CID | 7687 | ||
| ChemSpider ID | 7975 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | >100 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -70 °C | ||
| Σημείο βρασμού | 128-129 °C | ||
| Πυκνότητα | 943 kg/m³ | ||
| Διαλυτότητα στο νερό |
Αναμείξιμη | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η 2-μεθυλοπυριδίνη ή 2-πικολίνη[3] (αγγλικά 2-methylpyridine) είναι βασική ετεροκυκλική αρωματική (δηλαδή ετεροαρωματική) οργανική ένωση, που περιέχει άνθρακα, υδρογόνο και άζωτο, με μοριακό τύπο C6H7N. Η χημικά καθαρή 2-πικολίνη, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο ή ξεθωριασμένο κιτρινοπράσινο υγρό που έχει δυσάρεστη οσμή, παρόμοια με της «μητρικής» πυριδίνης. Είναι μία από τις τρεις (3) ισομερείς του μεθυλοπυριδίνες, των οποίων οι δομές διαφέρουν ανάλογα με τη θέση που η μεθυλομάδα (CH3) τους επισυνάπτεται γύρω από το πυριδινικό τους δακτύλιο.
Χρησιμοποιείται κυρίως για την παραγωγή βινυλοπυριδίνης, η οποία με τη σειρά της χρησιμεύει για τη βιομηχανία πλαστικών, και της νιτραπυρίνης, που είναι αγροχημικό[4].
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Η 2-πικολίνη ήταν η πρώτη «θυγατρική» πυριδίνη ένωση που αναφέρθηκε ότι απομονώθηκε σε χημικά καθαρή μορφή. Συγκεκριμένα, πρωτοαπομονώθηκε από τη λιθανθρακόπισσα, το 1846 από τον Τ. Άντερσον (T. Anderson).[5] Στις μέρες μας παράγεται κυρίως από δύο κύριες παραγωγικές οδούς:
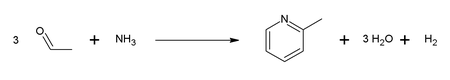
1. Συμπύκνωση ακεταλδεΰδης (CH3CHO), φορμαλδεΰδης (HCHO) και αμμωνίας (NH3).
2. Κυκλοποίηση της νιτριλίων (RCN) και ασετυλίνης (HC≡CH).
Παράδειγμα της #1 αντίδρασης είναι ο συνδυασμός της ακεταλδεΰδης και αμμωνίας:
Περίπου 8000 τόνοι/έτος παράγονταν παγκοσμίως στον κόσμο το 1989.[6]
Ακόμη, η παραγωγή της 2-μεθυλοπυριδίνης μπορεί να γίνει με διάφορες μεθόδους, που προκύπτουν από τις γενικές μεθόδους παραγωγής πυριδινών:
Με συντριμερισμό ενώσεων με τριπλό δεσμό
[Επεξεργασία | επεξεργασία κώδικα]Με μείγμα αιθινίου (HC≡CH) και αιθανονιτριλίου (CH3CN), σε αναλογία 2:1 υπέρ του πρώτου, παρουσία διαλυτών ενώσεων του κοβαλτίου, όπως το κοβαλτιοκένιο [Co(C5H5)2], παράγεται 2-μεθυλοπυριδίνη.[7] (Πρόκειται για τη #2 βιομηχανική παραγωγική οδό):
Με επίδραση εναμίνης σε β-δικαρβονυλική ένωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση 1-προπεν-2-αμίνης [CH2=C(NH)CH3] σε προπανοδιάλη (HCOCH2CHO), που αντιδρά με τη μορφή της ταυτομερούς της 3-υδροξυπροπενάλης (HOCH=CHCHO)[8]:
Με επίδραση 2- ή 5-μεθυλ-1,3-οξαζολίου σε αιθένιο και αφυδάτωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση 2-μεθυλ-1,3-οξαζολίου ή 5-αιθυλ-1,3-οξαζολίου σε αιθένιο (CH2=CH2), παράγεται αρχικά 2-μεθυλο-2-πυριδινόλη ή 5-μεθυλο-2,3-διυδρο-2-πυριδινόλη, αντίστοιχα, που και οι δύο δίνουν τελικά με αφυδάτωση 2-μεθυλοπυριδίνη:[8]
Χημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Η 2-μεθυλοπυριδίνη είναι μονοϋποκατεστημένη «θυγατρική» πυριδίνη και γι' αυτό είναι σημαντικά δραστικότερη από τη «μητρική» πυριδίνη και αρκετά δραστικότερη από τις μεθυλοπυριδίνες. Ιδιαίτερα, η μεθυλομάδα της 2-μεθυλοπυριδίνης δίνει αντιδράσεις με διάφορα αντιδραστήρια, όπως για παράδειγμα το φαινυλολίθιο (PhLi), που μεταφέρει το λίθιο στη 2-μεθυλομάδα.[9]
Ωστόσο και πάλι, τα ηλεκτρονιόφιλα αντιδραστήρια συνήθως προτιμούν να αντιδρούν με το περισσότερο ηλεκτραρνητικό και επομένως ισχυρότερο πυρινόφιλο άτομο αζώτου της 2-μεθυλοπυριδίνης, σχηματίζοντας άλατα 2-μεθυλοπυριδινωνίου.[10] Ο σχηματισμός του 2-μεθυλοπυριδινωνίου ενισχύει επιπλέον τη δραστικότητα της ένωσης έναντι πυρινόφιλων αντιδραστηρίων, που αντιδρά και πάλι με τη 2-μεθυλομάδα του.[9]
Αξιοσημείωτες αντιδράσεις και εφαρμογές αυτών
[Επεξεργασία | επεξεργασία κώδικα]Οι περισσότερες από τις αντιδράσεις της 2-πικολίνης έχουν επίκεντρο την μεθυλομάδα (CH3-) της. Για παράδειγμα, η κύρια χρήση της 2-πικολίνης είναι ως πρόδρομη ένωση της 2-βινυλοπυριδίνης. Η μετατροπή αυτή επιτυγχάνεται μετά από συμπύκνωση της 2-πικολίνης με φορμαλδεΰδη (ΗCHO):
Το συμπολυμερές 2-βινυλοπυριδίνης, 1,3-βουταδιένιου (CH2=CHCH=CH2) και στυρόλιου (PhVi) χρησιμοποιείται ως συγκολλητικό για την υφαντική ελαστικού νήματος. Η 2-πικολίνη είναι επίσης ένας πρόδρομη ένωση για τη νιτραπυρίνη, η οποία είναι αγροχημικό, που αποτρέπει την απώλεια της αμμωνίας από τα (αζωτούχα) λιπάσματα. Η 2-πικολίνη μετά από οξείδωση με υπερμαγγανικό κάλιο (KMnO4) παράγει 2-πικολινικό οξύ:
Η αποπρωτονίωση της μεθυλομάδας της 2-πικολίνης (για παράδειγμα) από βουτυλολίθιο (BuLi) δίνει 2-πικολινυλολίθιο (C5H4NCH2Li), που είναι ευέλικτο πυρινόφιλο αντιδραστήριο.[11]
Εφαρμογές παραγώγων σε φάρμακα
[Επεξεργασία | επεξεργασία κώδικα]- Η Ν-αλκυλίωση της 2-πικολίνης χρησιμοποιείται στην παραγωγή του αμπρολίου, ενός αντιπρωτοζωικού αντιβιοτικού.
- Η πικοπλατίνη είναι επίσης N-αλκυλιωμένο παράγωγο της 2-πικολίνης.
- Η διμεθινδενίνη επίσης είναι παράγωγο της 2-πικολίνης.
- Η ενκαϊνίδη, επίσης είναι παράγωγο της 2-πικολίνης.
- Η βουτοπροζίνη, επίσης είναι παράγωγο της 2-πικολίνης.
Βιοαποικοδόμηση
[Επεξεργασία | επεξεργασία κώδικα]Όπως άλλες «θυγατρικές» πυριδίνες, 2-μεθυλοπυριδίνη συχνά αναφέρεται ως περιβαλλοντικός ρυπαντής που σχετίζεται με εγκαταστάσεις επεξεργασίας σχιστολιθικού πετρελαίου ή αεριοποίησης άνθρακα, και έχει επίσης βρεθεί στις τοποθεσίες επεξεγασίας ξύλου legacy. Ωστόσο, η 2-μεθυλοπυριδίνη μπορεί να βιοαποικοδομηθεί γρήγορα, από ορισμένους μικροοργανισμούς, όπως το arthrobacter sp. στέλεχος R1 (ATTC στέλεχος #49987), το οποίο (πρωτο)απομονώθηκε από ένα μολυσμένο υδροφόρο ορίζοντα μαζί με ένα πολύπλοκο μείγμα (διαφόρων( «θυγατρικών» πυριδινών .[12] Το arthrobacter και οι στενά συνδεδεμένοι μαζί του ακτινομύκητες συχνά σχετίζονται με την αποικοδόμηση «θυγατρικών» πυριδινών, καθώς και άλλων αζωτούχων ετεροκυκλικών ενώσεων. Η 2-μεθυλοπυριδίνη και η 4-μεθυλοπυριδίνη παρουσιάζουν λιγότερη απώλεια πτητικοποίησης από περιβαλλοντικά δείγματα, σε σύγκριση με την 3-μεθυλοπυριδίνη.[13]
Δείτε επίσης
[Επεξεργασία | επεξεργασία κώδικα]- Πυριδίνη
- 3-μεθυλοπυριδίνη
- 4-μεθυλοπυριδίνη
- 2-αιθυλοπυριδίνη
- 3-αιθυλοπυριδίνη
- 2,3-λουτιδίνη
- 2,4-λουτιδίνη
- 2,5-λουτιδίνη
- 2,6-λουτιδίνη
- 3,4-λουτιδίνη
- 3,5-λουτιδίνη
- Τολουόλιο
- Ανιλίνη
- ο-τολουϊδίνη
Αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Συστηματική ονομασία
- ↑ Ονομασία αντικατάστασης
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Eric F. V. Scriven, Ramiah Murugan.
- ↑ Anderson, T. (1846). «On the constitution and properties of Picoline, a new organic base from Coal Tar» (Free full text at Google Books). Edinburgh New Phil. J. XLI: 146–156; 291–300. https://books.google.com/books?id=lB0AAAAAMAAJ&pg=PA146.
- ↑ Shinkichi Shimizu; Nanao Watanabe; Toshiaki Kataoka; Takayuki Shoji; Nobuyuki Abe; Sinji Morishita; Hisao Ichimura. (2002). «Pyridine and Pyridine Derivatives». Ullmann's Encyclopedia of Industrial Chemistry. doi:.
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη (1985). Χημεία Ετεροκυκλικών Ενώσεων. Θεσσαλονίκη: Ζήτης. σελ. 136.
- ↑ 8,0 8,1 Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη (1985). Χημεία Ετεροκυκλικών Ενώσεων. Θεσσαλονίκη: Ζήτης. σελ. 137.
- ↑ 9,0 9,1 Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη (1986). Χημεία Ετεροκυκλικών Ενώσεων. Θεσσαλονίκη: Ζήτης. σελ. 142-143.
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη (1985). Χημεία Ετεροκυκλικών Ενώσεων. Θεσσαλονίκη: Ζήτης. σελ. 138.
- ↑ Stephanie Ganssl; Julia Pedronil; Alexandre Lumbrosol; Günther Leonhardt-Lutterbeckl; Antje Meißnerl; Siping Weil; Hans-Joachim Drexlerl; Detlef Hellerl και άλλοι. (2016). «Rhodium-Catalyzed Addition of Carboxylic Acids to Terminal Alkynes towards Z-Enol Esters». Org. Synth. 93: 367–384. doi:.
- ↑ O'Loughlin, E. J., G.K. Sims, and S.J. Traina. 1999.
- ↑ Sims, G.K.; L.E. Sommers (1985). «Biodegradation of pyridine derivatives in soil suspensions». Environmental Toxicology and Chemistry 5: 503–509. doi:.

![{\displaystyle \mathrm {2HC\equiv CH+CH_{3}CN{\xrightarrow[{Co(C_{5}H_{5})_{2}}]{\triangle }}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a242a1a011b5190fdfddb4a78d5a17d7cec34637)





