Φουράνιο
| Φουράνιο | |||
|---|---|---|---|

| |||

| |||
| |||
| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Οξόλιο | ||
| Άλλες ονομασίες | Φουράνιο 1,4-εποξυ-1,3-βουταδιένιο 1,4-βουταδιεν-1,3-υλενοξείδιο Οξακυκλο-2,4-πενταδιένιο Φουρφουράνιο Τετρόλιο Διβυνιλοξείδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C4H4O | ||
| Μοριακή μάζα | 68,074 amu | ||
| Σύντομος συντακτικός τύπος |
|||
| Αριθμός CAS | 203-727-3 | ||
| SMILES | c1ccoc1 | ||
| InChI | 1S/C4H4O/c1-2-4-5-3-1/h1-4H | ||
| Αριθμός EINECS | 203-727-3 | ||
| Αριθμός RTECS | LT8524000 | ||
| PubChem CID | 8029 | ||
| ChemSpider ID | 7738 | ||
| Δομή | |||
| Διπολική ροπή | 0,7 D | ||
| Μοριακή γεωμετρία | Πενταγωνική | ||
| Ισομέρεια | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -85,6 °C | ||
| Σημείο βρασμού | 31,3 °C | ||
| Πυκνότητα | 936 kg/m3 | ||
| Διαλυτότητα στο νερό |
~10 kg/m3 | ||
| Διαλυτότητα σε άλλους διαλύτες |
Αιθανόλη Μεθανόλη Διμεθυλαιθέρας | ||
| Ιξώδες | 0,39 cP | ||
| Δείκτης διάθλασης , nD |
1,421 | ||
| Εμφάνιση | Άχρωμο πτητικό υγρό | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-69 °C | ||
| Σημείο αυτανάφλεξης | 390 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Εύφλεκτο (F) Τοξικό (Τ) | |||
| Φράσεις κινδύνου | 45-12-19-20/22-38-48/22-52/53-68 | ||
| Φράσεις ασφαλείας | 53-45-61 | ||
| LD50 | >2 g/kg | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
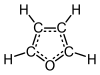
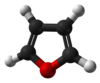
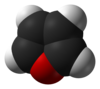
Το φουράνιο ή οξόλιο[1] (αγγλικά: furan ή oxole) είναι οργανική, ετεροαρωματική (δηλαδή ετεροκυκλική και αρωματική) ένωση, που αποτελείται από άνθρακα, υδρογόνο και οξυγόνο, με μοριακό τύπο C4H4Ο. Πιο συγκεκριμένα, είναι ένας ετεροαρωματικός αιθέρας, που το μόριό του αποτελείται από έναν πενταμελή δακτύλιο με ένα ετεροάτομο οξυγόνου. Η κλάση των ενώσεων που περιέχουν έναν τουλάχιστο τέτοιο δακτύλιο αναφέρεται επίσης ως «φουράνια» ή «οξόλια»
Στις συνηθισμένες συνθήκες, δηλαδή θερμοκρασία 25 °C και πίεση 1 atm, είναι ένα άχρωμο, εύφλεκτο, πολύ πτητικό υγρό, με θερμοκρασία βρασμού 31,3 °C, δηλαδή κοντά στη «θερμοκρασία δωματίου» (20 °C). Είναι ευδιάλυτο στους συνηθισμένους οργανικούς διαλύτες, όπως η αιθανόλη, ο διαιθυλαιθέρας και η προπανόνη, αλλά ελάχιστα διαλυτό στο νερό[2]. Είναι τοξικό και πιθανό καρκινογόνο. Το φουράνιο χρησιμοποιήθηκε ως ενδιάμεση ύλη για την παραγωγή άλλων «εξειδικευμένων χημικών προϊόντων»[3][4]. Εκτός από τη «μητρική» ένωση, ο όρος «φουράνο» επεκτείνεται και χρησιμοποιείται επίσης και για μια σειρά «θυγατρικών» ή υποκατεστημένων παραγώγων φουρανίων, που περιέχουν έναν (τουλάχιστον) φουρανικό δακτύλιο.
Ιστορικά στοιχεία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «φουράνιο», προέρχεται από τη λατινική λέξη «furfur», που σημαίνει πίτουρο[5], από την οποία προήλθε και η εναλλακτική ονομασία «φουρφουράνιο». Το πρώτο παράγωγο του φουρανίου ονομάστηκε 2-φουρoϊκό οξύ (πρόκειται για το α-καρβοξυφουράνιο), από τον Καρλ Βίλχελμ Σέελε (Carl Wilhelm Scheele) το 1780. Ένα άλλο σημαντικό παράγωγο, η φουρφουράλη (πρόκειται για το α-φορμυλοφουράνιο), αναφέρθηκε από τον Γιόχαν Βόλφγκανγκ Ντεμπεράϊνερ (Johann Wolfgang Döbereiner) το 1831 και χαρακτηρίστηκε το 1840 από τον Τζον Στένχαουζ (John Stenhouse). Το ίδιο το φουράνιο παρασκευάστηκε για πρώτη φορά από τον Χένρυ Λίμπριχτ (Henry Limpricht), το 1870, παρ' όλο που ο ίδιος το ονόμασε «τετραφαινόλη»[6][7].
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιομηχανική[4]
[Επεξεργασία | επεξεργασία κώδικα]Από φουρφουράλη
[Επεξεργασία | επεξεργασία κώδικα]1. Κατά την κατεργασία φλοιών βρώμης, καλαμποκιού ή και ρυζιού με θερμό υδροχλωρικό οξύ, οι πεντοζάνες (πολυπεντοζίδια), που περιέχουν, υδρολύονται προς πεντόζες, οι οποίες στη συνέχεια υφίστανται αφυδάτωση και κυκλοποίηση, σχηματίζοντας φουρφουράλη. Με αποκαρβονυλίωση (απόσπαση CO) της φουρφουράλης με ατμό, σε αναλογία 1:5 - 1:10, στους 400 °C, προκύπτει το φουράνιο με απόδοση 90 %:

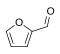
2. Το 1959, η εταιρεία DuPont ανέπτυξε μια συνθετική μέθοδο παραγωγής φουρανίου από φουρφουράλη, χρησιμοποιώντας λευκόχρυσο ως καταλύτη. Με τον τρόπο αυτό αποφεύγεται η χρήση ατμού και η μετατροπή της φουρφουράλης υπό πίεση και σε θερμοκρασία 200 °C. Αργότερα, προτιμήθηκε το παλλάδιο ως καταλύτης:
Από 1,3-βουταδιένιο
[Επεξεργασία | επεξεργασία κώδικα]Μια άλλη δυνατότητα είναι η μερική οξείδωση του 1,3-βουταδιένιου. Η τεχνική αυτή έχει αναπτυχθεί επίσης από την DuPont, το 1957. Η αντίδραση χρησιμοποιεί τριοξείδιο του μολυβδαινίου (MoO3) ως καταλύτη στους 500 °C. Δοκιμάστηκαν επίσης και άλλοι καταλύτες, για την ίδια αντίδραση, όπως οξείδια του φωσφόρου, του βαναδίου, ή και του αντιμονίου, το τελευταίο ενισχυμένο με κασσίτερο, χαλκό η βολφράμιο. Ωστόσο, η απόδοση της αντίδρασης είναι κάτω του 15 %. Η εταιρεία DuPont συνέχισε την έρευνα για την ανάπτυξη μεθόδων βιομηχανικής παρασκευής φουρανίου και, το 1987, ανακαλύφθηκε μια διαδικασία σε χαμηλότερη θερμοκρασία (90° - 120 °C): το 1,3-βουταδιένιο εξατμίζεται και στη συνέχεια οξειδώνεται από διχλωριούχο χαλκό σε υδατικό διάλυμα χλωριούχου χαλκού, διχλωριούχου χαλκού και με την παρουσία χλωριούχου νατρίου, ιωδιούχου καλίου και υδροχλωρικού οξέος. Η απόδοση είναι περίπου 20%:
Εναλλακτικές μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]1. Το φουράνιο μπορεί να παρασκευαστεί και με αποκαρβοξυλίωση του 2-φουροϊκού οξέος στους 200 °C - 205 °C:
2. Ορισμένα υποκατεστημένα φουράνια παρασκευάζονται από άκυκλες ενώσεις με κυκλοποίηση. Για παράδειγμα, από την 2,5-εξανοδιόνη, με επίδραση P2O5 και θέρμανση, προκύπτει 2,5-διμεθυλοφουράνιο (σύνθεση Paal-Knorr, 1885):
3. Από α-αλοκετόνες και β-δικαρβονυλικές ενώσεις, προκύπτουν, με τη σύνθεση Feist-Benary, παράγωγα του φουρανίου:
Χημικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]
Το p ατομικό τροχιακό του ενός από τα δύο μονήρη ζεύγη ηλεκτρονίων του ατόμου του οξυγόνου είναι ομοεπίπεδο με τα 2π μοριακά τροχιακά των δύο (2) διπλών δεσμών μεταξύ των ατόμων άνθρακα του φουρανίου. Ο sp² υβριδισμός των τεσσάρων (4) ατόμων άνθρκακα επιτρέπει σε ένα από τα δύο μονήρη ζεύγη ηλεκτρονίων του ατόμου του οξυγόνου να «μετατοπίζεται» και να αλληλεπιδρά με το π - σύστημα των δύο (2) εναλλάξ διπλών δεσμών μεταξύ των τεσσάρων (4) ατόμων άνθρακα. Το άλλο μονήρες ζεύγος ηλεκτρονίων του ατόμου του οξυγόνου εκτείνεται στο επίπεδο του δακτυλίου. Έτσι, το φουράνιο είναι μια αρωματική ένωση, γιατί τα 2 μονήρη ηλεκτρόνια του ατόμου του οξυγόνου, μαζί με τα 4π - ηλκετρόνια των ατόμων άνθρακα, δημιουργούν ένα ενιαίο επίπεδο σύστημα (συνολικά) 6π ηλεκτρονίων, δηλαδή ένα σύστημα που «υπακούει» στον κανόνα του Hückel (4n+2 π ηλεκτρόνια, για n=1), όπως το βενζόλιο. Εξαιτίας της αρωματικότητάς του, το μόριο του φουρανίου δεν έχει διακριτούς, δηλαδή εντοπισμένους διπλούς δεσμούς. Έτσι, ο τύπος του φουρανίου απεικονίζεται με τις ακόλουθες δομές συντονισμού:
Εξαιτίας της αρωματικότητάς του, η χημική συμπεριφορά του φουρανίου είναι εντελώς διαφορετική από τη συμπεριφορά των συνηθισμένων ετεροκυκλικών αιθέρων, όπως το τετραϋδροφουράνιο. Το ετεροάτομο, ωστόσο κάνει το φουράνιο πολύ δραστικότερο του βενζολίου και γι' αυτό χρησιμοποιούνται ειδικά ήπια αντιδραστήρια που εφαρμόζονται και σε άλλα δραστικά αρωματικά μόρια. Όπως φαίνεται και στην εικόνα της ηλεκτρονιακής πυκνότητας, οι α-θέσεις είναι δραστικότερες από τις β-θέσεις. Έχει την τάση να αντιδρά με ηλεκτρονιόφιλα αντιδραστήρια (Ε+) και να δίνει προϊόντα αρωματικής ηλεκτρονιόφιλης υποκατάστασης:
Παραδείγματα αντιδράσεων αρωματικής ηλεκτρονιόφιλης υποκατάστασης σε φουράνιο
[Επεξεργασία | επεξεργασία κώδικα]Σουλφούρωση
[Επεξεργασία | επεξεργασία κώδικα]Η σουλφούρωση φουρανίου γίνεται συνήθως από σύμπλοκο πυριδίνης-τριοξειδίου του θείου στους 100 °C, σχηματίζοντας 2-φουρανοσουλφονικό οξύ:
Ακετυλίωση
[Επεξεργασία | επεξεργασία κώδικα]Η ακετυλίωση κατά Friedel-Crafts σε φουράνιο γίνεται συνήθως με οξικό ανυδρίτη και διάλυμα άλατος τριφθοριούχου βορίου σε διαιθυλαιθέρα, σχηματίζοντας 2-ακετυλοφουράνιο:
Καταλυτική υδρογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Το φουράνιο υδρογονώνεται καταλυτικά (παρουσία νικελίου) σε χαμηλή θερμοκρασία (50 °C) δίνοντας τετραϋδροφουράνιο, το οποίο δεν έχει αρωματικές ιδιότητες και παρουσιάζει συμπεριφορά αλειφατικού αιθέρα :
Παραδείγματα άλλων ειδών αντιδράσεων του φουρανίου
[Επεξεργασία | επεξεργασία κώδικα]Διενική σύνθεση
[Επεξεργασία | επεξεργασία κώδικα]Λειτουργεί ως διένιο στη διενική σύνθεση (αντίδραση Diels-Alder) και αντιδρά με διενόφιλα. Για πααράδειγμα όταν αντιδρά με τον 3-νιτροπροπενικό αιθυλεστέρα (2), το προϊόν είναι μίγμα ενδομορφής (3a) και εξωμορφής (3b) με αναλογία 70:30 αντίστοιχα:
Μετατροπή σε πυρρόλιο
[Επεξεργασία | επεξεργασία κώδικα]Το πυρρόλιο παράγεται βιομηχανικά με επίδραση αμμωνίας σε φουράνιο, παρουσία στερεών όξινων (κατά Λιούις) καταλυτών, όπως το Διοξείδιο του πυριτίου (SiO2) και η αλουμίνα (Al2O3)[8]:
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Το φουράνιο χρησιμοποιείται κυρίως ως πρόδρομη ένωση για την παρασκευή άλλων ενώσεων όπως π.χ. το τετραϋδροφουράνιο που χρησιμοποιείται κυρίως ως διαλύτης του 2,5-διμεθοξυ-2,5-διυδροφουράνιου που χρησιμοποιείται στη φωτογραφία. Από το φουράνιο επίσης παρασκευάζονται διάφορα φυτοπροστατευτικά προϊόντα, όπως η ενδοθάλλη. Το φουράνιο χρησιμοποιείται επίσης για τη παρασκευή πολυμερών που χρησιμοποιούνται ως πρόσθετα σε προϊόντα καθαρισμού και απορρυπαντικά. Το πλεονέκτημα αυτών των πρόσθετων είναι ότι δεν περιέχουν άζωτο ή φωσφόρο.
Επίδραση του φουρανίου στην υγεία
[Επεξεργασία | επεξεργασία κώδικα]Το φουράνιο σε δόση μεταξύ 2 mg/kg - 4 mg/kg σωματικού βάρους έχει αποδειχθεί ότι προκαλεί καρκίνο του χοληφόρου πόρου σε αρουραίους και καρκίνο του ήπατος σε ποντίκια[9]. Δεν έχουν όμως αναφερθεί αρκετά μακροχρόνιες δοκιμές πάνω στις επιπτώσεις του φουρανίου στην ανθρώπινη υγεία. Το φουράνιο έχει βρεθεί σε καφέδες, καθώς και σε κονσερβοποιημένα και εμφιαλωμένα τρόφιμα[10], συμπεριλαμβανομένων και των αντίστοιχων παιδικών τροφών.
Πηγές πληροφόρησης
[Επεξεργασία | επεξεργασία κώδικα]- Meislich H., Nechamkin H., Sharefkin J. "Οργανική Χημεία", Μετάφραση:Βάρβογλης Α., Αθήνα 1983.
- Morrison R. T., Boyd R. N. "Οργανική Χημεία" Τόμοι 1ος,2ος,3ος, Μετάφραση:Σακαρέλλος-Πηλίδης-Γεροθανάσης, Ιωάννινα 1991.
- Βάρβογλης Α. "Χημεία Οργανικών Ενώσεων", Θεσσαλονίκη 1986.
- Μανωλκίδης Κ., Μπέζας Κ. "Στοιχεία οργανικής χημείας", Έκδοση 13η, Αθήνα 1985.
- Αλεξάνδρου Ν. Ε. "Γενική Οργανική Χημεία, Δομή-Φάσματα-Μηχανισμοί", Τόμοι 1ος και 2ος, Θεσσαλονίκη 1985.
- Τσακιστράκης Α. "Οργανική Χημεία", Αθήνα 1993
- Ιακώβου Π. "Οργανική Χημεία. Σύγχρονη Θεωρία και Ασκήσεις", Θεσσαλονίκη 1995.
- Τσίπης Κ. Α. "Εισαγωγή στην Κβαντική Χημεία, Τόμος ΙΙ, Κβαντοχημική Μελέτη Μοριακής Δομή", Θεσσαλονίκη 1985.
- Salem L. "Electrons in Chemical Reactions", Orsay, France 1982
- Παπαγεωργίου, Β.Π., Εφαρμοσμένη Οργανική Χημεία, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 2005, ISBN 960-260-342-7
- SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
- «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
- Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
- Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ Έκδοση Θεσσαλονίκη 1991
- Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, Θεσσαλονίκη 1983
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Δημητρίου Ν. Νικολαΐδη: «Χημεία Ετεροκυκλικών Ενώσεων», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Διαδικτυακοί τόποι που αναφέρονται στις «Αναφορές και παρατηρήσεις».
Εξωτερικοί σύνδεσμοι
[Επεξεργασία | επεξεργασία κώδικα]- Πρόσφατες συνθετικές μέθοδοι φουρανίου και παραγώγων του
- Ισομερή του φουρανίου
- Γενικά για ετεροκυκλικές ενώσεις
Παραπομπές και παρατηρήσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Δείτε στον πίνακα τις εναλλακτικές ονομασίες
- ↑ Hans Dieter Jakubke; Hans Jeschkeit (1994). Concise Encyclopedia of Chemistry. Walter de Gruyter. pp. 001–1201. ISBN 0-89925-457-8.
- ↑ Τα «εξειδικευμένα χημικά προϊόντα» είναι ιδιαίτερη κατηγορία χημικών προϊόντων που αποτελούνται από μια χημική ουσία, σε σχετικα΄υψηλό βαθμό καθαρότητας, σχετικά μικρή παγκόσμια παραγωγή (< 1.000 τόννοι το χρόνο) και σχετικά υψηλή τιμή (>10$/kg).
- ↑ 4,0 4,1 H. E. Hoydonckx, W. M. Van Rhijn, W. Van Rhijn, D. E. De Vos, P. A. Jacobs (2005), "Furfural and Derivatives", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a12_119.pub2.
- ↑ Alexander Senning. Elsevier's Dictionary of Chemoetymology. Elsevier, 2006. ISBN 0-444-52239-5.
- ↑ Limpricht, H. (1870). "Ueber das Tetraphenol C4H4O". Berichte der deutschen chemischen Gesellschaft 3 (1): pp. 90–91. doi:10.1002/cber.18700030129.
- ↑ Rodd, Ernest Harry (1971). Chemistry of Carbon Compounds: A Modern Comprehensive Treatise. Elsevier.
- ↑ Albrecht Ludwig Harreus "Pyrrole" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_453
- ↑ National Toxicology Program, 1993; Moser et al. 2009.
- ↑ Γιατί είναι παραπροίόν της θερμικής κατεργασίας τροφίμων που περιέχουν πεντόζες. Πρόκειται για παρόμοια διεργασία με τη βιομηχανική παραγωγή του φουρανίου μέσω φουρφουράλης, που περιγράφεται στην ενότητα 2.1.1., περίπτωση #1, παραπάνω.


![{\displaystyle \mathrm {{\xrightarrow[{200^{o}C,\;\pi {\acute {\iota }}\epsilon \sigma \eta }]{Pd}}CO+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6bfa7c98127a4ea75bd4caf2ad76d45ccb18b5ca)














![{\displaystyle \mathrm {+2H_{2}{\xrightarrow[{50^{o}C}]{Ni}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ce10f3d70fa2b52c292f929fbede1249a51d8e2)


