Οξιράνιο
| Οξιράνιο | |||
|---|---|---|---|

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Οξιράνιο | ||
| Άλλες ονομασίες | Εποξυαιθάνιο Αιθυλενοξείδιο Οξακυκλοπροπάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C2H4O | ||
| Μοριακή μάζα | 44,05 amu | ||
| Σύντομος συντακτικός τύπος |
|||
| Αριθμός CAS | 75-21-8 | ||
| SMILES | O1CC1 | ||
| InChI | 1S/C2H4O/c1-2-3-1/h1-2H2 | ||
| Αριθμός EINECS | 200-849-9 | ||
| Αριθμός RTECS | KX2450000 | ||
| Αριθμός UN | JJH7GNN18P | ||
| PubChem CID | 6354 | ||
| ChemSpider ID | 6114 | ||
| Δομή | |||
| Μοριακή γεωμετρία | τριγωνική ως προς C-C-O. | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 2 Αιθενόλη Αιθανάλη | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -111,3 °C | ||
| Σημείο βρασμού | 10,7 °C | ||
| Πυκνότητα | 882 kg/m3 | ||
| Διαλυτότητα στο νερό |
Αναμείξιμο | ||
| Χημικές ιδιότητες | |||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-20 °C | ||
| Σημείο αυτανάφλεξης | 429 °C | ||
| Επικινδυνότητα | |||
 
| |||
| Εύφλεκτο (F+) Τοξικό Καρκινογόνο | |||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το οξιράνιο[1] (αγγλικά oxirane) είναι οργανική ετεροκυκλική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και οξυγόνο, με μοριακό τύπο C2H4O. Συνήθως όμως παριστάνεται με τον γραμμικό του τύπο (![]() ). Είναι ο απλούστερος ετεροκυκλικός αιθέρας.[2]
). Είναι ο απλούστερος ετεροκυκλικός αιθέρας.[2]
Το χημικά καθαρό οξιράνιο, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο, εύφλεκτο αέριο, με (απατηλή) γλυκιά οσμή, παρόμοια με αυτή του αιθέρα, (και αυτό) όταν έχει συγκέντρωση που βρίσκεται (ήδη) σε τοξικά επίπεδα. Ωστόσο, είναι ένα από τα πιο σημαντικά ενδιάμεσα προϊόντα της χημικής βιομηχανίας.
Δομικά, το μόριό του αποτελείται από έναν τριμελή (και επομένως τριγωνικό) δακτύλιο, που περιέχει δύο (2) άτομα άνθρακα και ένα (1) άτομο οξυγόνου. Κάθε άτομο άνθρακα συνδέεται με το άλλο άτομο άνθρακα, το άτομο οξυγόνου, και επιπλέον με δύο (2) άτομα υδρογόνου. Λόγω του τριμελούς δακτυλίου, έχει υψηλή «ενέργεια τάσης δεσμών», που εκφράζεται με αυξημένη αποθηκευμένη χημική ενέργεια, όπως ομοίως και άλλα ανάλογα μόρια, όπως για παράδειγμα αυτά του κυκλοπροπανίου και της αζιριδίνης. Η υψηλή ενέργεια συνεπάγεται σχετικά εύκολες αντιδράσεις 1,3-προσθήκης, με διάνοιξη του δακτυλίου, συνήθως με θραύση του ενός δεσμού C-O. Με βάση χημικό τύπο του (C2H4O) έχει δύο (2) ισομερή θέσης, την αιθανάλη (CH3CHO) και την ελάσσονα ταυτομερή της αιθενόλη (CH2=CHOH). Βιομηχανικά παράγεται με καταλυτική οξείδωση αιθενίου, με τη χρήση αργύρου ως καταλύτη.
Παρόλο που είναι μια κομβικής σημασίας ενδιάμεση ύλη για τη χημική βιομηχανία, με πολλά χρήσιμα παράγωγα, που περιλαμβάνουν το πολυσορβικό 20 και την πολυαιθυλενική γλυκόλη, το ίδιο το οξιράνιο είναι πολύ βλαβερή ουσία, γιατί (όπως αναφέρθηκε και παραπάνω) στις κανονικές συνθήκες περιβάλλοντος είναι αέριο εύφλεκτο, καρκινογόνο, μεταλλαξιογόνο, ερεθιστικό και αναισθητικό,[3] με ένα παραπλανητικό ευχάριστο άρωμα.
Η χημική δραστικότητα του οξιρανίου, που είναι υπεύθυνη για πολλές από τις βλαβερές (για τον ανθρώπινο οργανισμό και φυσικά όχι μόνο) ιδιότητές του, είναι επίσης υπεύθυνη για το ότι είναι μια ουσία που έχει νευραλγική σημασία για τη χημική βιομηχανία, και που υποστηρίζει (σε σημαντικό βαθμό) το επίπεδο ζωής των προηγμένων κοινωνιών και οικονομιών του πλανήτη μας. Επίσης, παρόλο που είναι πολύ επικίνδυνο για οικιακή χρήση, και γι' αυτό σχετικά άγνωστο στους περισσότερους από τους απλούς καταναλωτές, το οξιράνιο χρησιμοποιείται ως πρόδρομη ένωση για τη βιομηχανική παραγωγή πολλών καταναλωτικών και μη χημικών προϊόντων, τελικών και ενδιαμέσων. Ενδεικτικά, είναι από χρήσιμο ως απαραίτητο για την παραγωγή απορρυπαντικών, πηκτικών, διαλυτών, πλαστικών και διαφόρων οργανικών χημικών, όπως η 1,2-αιθανοδιόλη, οι αιθανολαμίνες, διάφορες απλές και σύνθετες γλυκόλες, οι πολυγλυκολικοί αιθέρες και άλλες ενώσεις. Ως δηλητηριώδες αέριο, που δεν αφήνει ίχνη στα αντικείμενα με τα οποία έρχεται σε επαφή, το χημικά καθαρό οξιράνιο είναι αποστειρωτικό, που χρησιμοποιείται ευρύτατα από νοσοκομεία και από τη βιομηχανία παραγωγής ιατρικού εξοπλισμού, σε αντικατάσταση της χρήσης ατμού σε υλικά που είναι ευαίσθητα στη θερμότητα, όπως οι μίας χρήσης πλαστικές σύριγγες[4].
Είναι εξαιρετικά εύφλεκτο αλλά και εκρηκτικό, οπότε χρησιμοποιείται και ως κύριο συστατικό σε θερμοβαρικά οπλικά συστήματα[5][6]. Για τον ίδιο λόγο χρησιμοποιείται και μεταφέρεται ως καταψυγμένο υγρό, για να ελεγχθεί η βλαπτική φύση του.[3]
Το οξιράνιο είναι η «μητρική ένωση» για μια σειρά «θυγατρικών» του παραγώγων, που μαζί με τη «μητρική ένωση», ονομάζονται συλλήβδην «οξιράνια».
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Το οξιράνιο παρασκευάστηκε για πρώτη φορά το 1859 από το γάλλο χημικό Σαρλ-Αντόλφ Βυρτς (Charles-Adolphe Wurtz), μετά από κατεργασία 2-χλωραιθανόλης (ClCH2CH2OH) με υδροξείδιο του καλίου (KOH):
Ο Βουρτζ μέτρησε και την (κανονική) θερμοκρασία βρασμού του οξιρανίου (13,5 °C, λίγο υψηλότερη από την τιμή που ισχύει σήμερα, δηλαδή 10,7 °C) και ανακάλυψε την ικανότητά του να αντιδρά με οξέα και με άλατα μετάλλων[7]. Ο Βουρτζ νόμισε (λανθασμένα) ότι το οξιράνιο έχει τις ιδιότητες μιας οργανικής βάσης. Αυτή η παρανόηση συνεχίστηκε μέχρι το 1896, όταν ο Γκεόργκ Μπρέντιγκ (Bredig) βρήκε ότι το οξιράνιο δεν είναι ηλεκτρολύτης[7][8] (και επομένως δεν μπορεί να είναι βάση, κλασσικού τύπου τουλάχιστον). Ακόμη, ήταν αντικείμενο διαφωνίας για ένα μακρύ (σχετικά) χρονικό διάστημα, για το αν διέφερε από τους άλλους (κορεσμένους) αιθέρες, κυρίως ως προς τη ροπή του να εμπλέκεται σε αντιδράσεις προσθήκης, όπως είναι τυπικό στις ακόρεστες ενώσεις. Η ετεροκυκλική τριγωνική δομή του οξιρανίου προτάθηκε τουλάχιστον από το 1868[9].
Η μέθοδος που πρωτοχρησιμοποίησε ο Βυρτς το 1859, παρέμεινε επί μακρύ (σχετικά) χρονικό διάστημα η μοναδική για την παραγωγή του οξιρανίου, παρόλο που έγιναν πολυάριθμες απόπειρες από επιστήμονες, που συμπεριλάμβαναν και τον ίδιο τον Βυρτς, για την παραγωγή του απευθείας από το αιθένιο[10]. Τελικά, το 1931, ο επίσης Γάλλος χημικός Τεοντόρ Λεφόρ (Theodore Lefort), ανέπτυξε μια μέθοδο απεθείας οξυγόνωσης αιθενίου, παρουσία αργύρου ως καταλύτη[11]. Μέχρι το 1940, ήδη σχεδόν όλη η βιομηχανική παραγωγή του οξιρανίου γινόταν με τη νέα μέθοδο[12]. Η αποστείρωση με οξιράνιο για τη συντήρηση μπαχαρικών πατενταρίστηκε το 1938 από τον αμερικανό χημικό Λόυντ Χολ (Lloyd Hall). Το οξιράνιο είχε υψηλή βιομηχανική σημασία κατά τη διαρκεια του Α΄ Παγκοσμίου Πολέμου, ως πρόδρομη ένωση τόσο για την 1,2-αιθανοδιόλη, που χρησιμοποιείται ως αντιψυκτικό, όσο και (ως πρόδρομη ύλη) για το χημικό όπλο που έγινε γνωστό ως «αέριο μουστάρδας».
Μοριακή δομή και ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]
Ο ετεροκυκλικός δακτύλιος του οξιρανίου σχηματίζει ένα σχεδόν ισόπλευρο τρίγωνο, με δεσμικές γωνίες περίπου 60°, έχοντας, επομένως, μια σημαντική «γωνιακή παραμόρφωση» και μια επακόλουθη ενέργεια τάσης δεσμών 105 kJ/mol[13][14]. Για σύγκριση, ο δεσμός C-O-Η στις αλκοόλες είναι περίπου 110° και ο δεσμός C-O-C στους αιθέρες είναι 120°. Οι ροπές αδράνειας γύρω από τους κύριους άξονες είναι IA = 32,921·10−40 g·cm², IB = 37,926·10−40 g·cm² και IC = 59,510·10−40 g·cm²[15]. Η διπολική ροπή σε μια θερμοκρασία μέσα στο εύρος 17-176 °C είναι 6,26·10−30 C·m[16].
Η σχετική αστάθεια των δεσμών C-Ο στο μόριο αποκαλύπτεται με τη σύγκριση στον παρακάτω πίνακα ενεργειών που απαιτούνται για τη θραύση των δύο (2) δεσμών C-Ο του οξιρανίου σε σχέση με την ενέργεια θραύσης ενός (1) μόνο δεσμού C-Ο στην αιθανόλη και στο διμεθυλαιθέρα:
| Αντίδραση | ΔH°298, kJ/mol | Μέθοδος |
|---|---|---|
| 354,38 | Υπολογισμένη από τις ατομικές ενθαλπίες. | |
| C2H5OH → C2H5 + OH (Θραύση ενός (1) δεσμού) | 405,85 | Πρόσκρουση ηλεκτρονίου |
| CH3OCH3 → CH3Ο + CH3 (Θραύση ενός (1) δεσμού) | 334,72 | Υπολογισμένη χρησιμοποιώντας τις ενθαλπίες σχηματισμού ελευθέρων ριζών. |
Αυτή η αστάθεια καθορίζει τη χημική δραστικότητα του οξιρανίου και εξηγεί την ευκολία διάνοιξης του δακτυλίου του σε αντιδράσεις 1,3-προσθήκης.
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιομηχανική
[Επεξεργασία | επεξεργασία κώδικα]Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Η εμπορικής κλίμακας παραγωγή οξιρανίου χρονολογείται από το 1914, όταν η εταιρεία BASF έχτισε το πρώτο της εργοστάσιο που χρησιμοποιούσε τη μέθοδο της χλωρυδρίνης, δηλαδή την επίδραση υδροξειδίου του ασβεστίου [Ca(OH)2] σε 2-χλωραιθανόλη:
Ωστόσο, η μέθοδος αυτή είναι μη ελκυστική για αρκετούς λόγους, που συμπεριλαμβάνουν τη (σχετικά) μικρή απόδοση και απώλεια σημαντικής αξίας χλωρίου στη μορφή του χλωριούχου ασβεστίου (CaCl2).[17] Η πιο αποδοτική μέθοδος της απευθείας οξυγόνωσης αιθενίου από τον ατμοσφαιρικό αέρα εφευρέθηκε από το Λεφόρτ το 1931 και η εταιρεία Union Carbide άνοιξε το 1937 την πρώτη της παραγωγική μονάδα παραγωγής οξιρανίου βασιζόμενη σε αυτήν την καινοτομία. Η μέθοδος βελτιώθηκε περαιτέρω το 1958 από την εταιρεία Shell Oil Co., αντικαθιστώντας τον ατμοσφαιρικό αέρα με (καθαρότερο) οξυγόνο, χρησιμοποιώντας αυξημένη θερμοκρασία 200-300 °C και πίεση 1-3 MPa:[18][3]
Με αυτήν την αποτελεσματικότερη διεργασία παρήχθηκε περίπου το ήμισι της εθνικής παραγωγής οξιρανίου των ΗΠΑ κατά τη δεκαετία του 1950 και μετά το 1975 αντικατέστησε (σχεδόν) τελείως (πλέον) τις άλλες μεθόδους βιομηχανικής παραγωγής οξιρανίου.[18] Η παραγωγή του οξιρανίου αποτελεί περίπου το 11% της παγκόσμιας ζήτησης αιθενίου.[19] Η απόδοση της αντίδρασης μπορεί να φθάσει και το 80%. Η παγκόσμια ετήσια παραγωγή οξιρανίου είναι περίπου 11 εκατομμύρια τόνοι.
Ανάλυση μεθόδου χλωρυδρίνης
[Επεξεργασία | επεξεργασία κώδικα]Παρόλο που η μέθοδος παραγωγής οξιρανίου από χλωρυδρίνη έχει σχεδόν τελείως αντικατασταθεί από την απευθείας οξείδωση αιθενίου, η γνώση αυτής της παλαιάς μεθόδου είναι ακόμη σημαντική για εκπαιδευτικούς σκοπούς, αλλά και γιατί χρησιμοποιείται ακόμη για την παραγωγή του μεθυλοξιρανίου.[20] Η μέθοδος αυτή αποτελείται από τρία (3) κύρια βήματα:
- Σύνθεση 2-χλωραιθανόλης
- Αφυδροχλωρίωση της 2-χλωραιθανόλης σε οξιράνιιο.
- Καθαρισμός του παραγώμενου οξιρανίου.
Τα βήματα αυτά διεξάγεται συνεχόμενα, σε τρεις (3) συνεχόμενες στήλες. Το βήμα #1, δηλαδή η σύνθεση της 2-χλωραιθανόλης αρχίζει με την υποχλωρίωση αιθενίου. Η διεργασια αυτή διεξάγεται ως ακολούθως:[21]
Η τελευταία αντίδραση είναι (εδώ) ανεπιθύμητη. Για να κατασταλθεί (μερικώς βέβαια) διατηρείται η συγκέντρωση του αιθενίου σε περίπου 4–6%, ενώ επιπλέον το διάλυμα θερμαίνεται με ατμό στη θερμοκρασία βρασμού. [21] Αμέσως μετά αρχίζει το δεύτερο στάδιο της όλης διεργασίας: Το υδατικό διάλυμα 2-χλωραιθανόλης που παράχθηκε από το στάδιο #1 εισέρχεται σε στη δεύτερη στήλη, όπου αντιδρά με υδατικό διάλυμα υδροξειδίου του ασβεστίου 30% στους 100 °C:[21]
Το παραγώμενο από το βήμα #2 οξιράνιο καθαρίζεται με ανόρθωση (rectification), που πραγματοποιείται στην τρίτη στήλη και αποτελεί το βήμα #3 της μεθόδου.
Η μέθοδος της χλωρυδρίνης επιτρέπει ως και 95% τη μετατροπή 2-χλωραιθανόλης σε οξιράνιο. Η συνολική απόδοση της μεθόδου σε οξιράνιο είναι θεωρητικά περίπου 80%, ως προς την αρχική πρόδρομη ύλη (αιθένιο), ενώ το υπόλοιπο περίπου 20% είναι 1,2-διχλωραιθάνιο, που παράγεται ως παραπροϊόν. [21]
Ωστόσο, το κύριο μειονέκτημα αυτής της μεθόδου είναι η (σχετικά) υψηλή κατανάλωση χλωρίου και τα συμπαραγώμενα απόβλητα. Η μέθοδος αυτή είναι ξεπερασμένη, όσων αφορά την παραγωγή του «μητρικού» οξιρανίου, αλλά βρίσκεται σε χρήση (βεβαίως τροποποιημένη) για την παραγωγή «θυγατρικών» οξιρανίων και κυρίως του μεθυλοξιρανίου.
Απευθείας οξείδωση του αιθενίου
[Επεξεργασία | επεξεργασία κώδικα]Εφαρμογές στην παγκόσμια χημική βιομηχανία
[Επεξεργασία | επεξεργασία κώδικα]Η απευθείας οξείδωση του αιθενίου (από οξυγόνο), όπως αναφέραμε και παραπάνω, ήταν καινοτομία του Λεφόρτ από το 1931. Η μέθοδός του τροποποποιήθηκε διαδοικά για να χρησιμοποιηθεί ολοένα βελτιωμένη από τη χημική βιομηχανία, καθώς η τελευταία εξελίσσονταν. Συνολικά, τουλάχιστον τέσσερεις (4) κύριες παραλλαγές είναι γνωστές. Όλες τους χρησιμοποιούν την άμεση οξείδωση αιθενίου από το οξυγόνο του ατμοσφαιρικού αέρα, ή και χημικά καθαρότερο οξυγόνο, με τη χρήση καταλύτη με βάση τον άργυρο, αλλά οι παραλλαγές αυτές διαφέρουν σε τεχνολογικές λεπτομέρειες και τρόπους σχεδιασμού και κατασκευής των συσκευών παραγωγής.[22]
Η εταιρεία Union Carbide, που πλέον είναι μια υποεταιρεία της Dow Chemical Company, ήταν η πρώτη εταιρεία που ανέπτυξε την πατέντα του Λεφόρτ για άμεση οξείδωση αιθενίου σε οξιράνιο.[23]
Παρόμοια μέθοδο παραγωγής ανέπτυξε η εταιρεία Scientific Design Co., αλλά έλαβε μεγαλύτερο μερίδιο παραγωγής, εξαιτίας του συστήματος αδειοδότησης, έχοντας αποκτήσει το 25% της συνολικής παγκόσμιας παραγωγής οξιρανίου και το 75% της παγκόσμιας αδειοδοτημένης παραγωγής οξιρανίου.[23][24]
Μια ιδιόκτητη πατέντα - τροποποιημένη μέθοδος παραγωγής χρησιμοποιείται από την Ιαπωνική εταιρεία Catalytic Chemical Co., που υιοθέτησε τη συμπαραγωγή οξιρανίου και 1,2-αιθανοδιόλης, στο ίδιο βιομηχανικό συγκρότημα.
Μια διαφορετική τροποποίηση της παραγωγής ανέπτυξε η Shell International Chemicals BV. Η μέθοδος αυτή είναι μάλλον ευέλικτη και τροποποιεί την παραγωγή ανάλογα με τις απαιτήσεις των εξειδικευμένων εταιρειών-πελατών, με σεβασμό στην ποιότητα του προϊόντος και διατηρώντας το χρησιμοποιούμενο καταλύτη για τριά (3) έτη. Το μερίδιο αγοράς της ανέρχεται στο 40% της παγκόσμιας παραγωγής οξιρανίου.[24]
Τα παλαιότερα εργοστάσια προτιμούν το ατμοσφαιρικό οξυγόνο ως οξειδωτικό μέσο, ενώ τα νεώτερα, όπως το METEOR και η Japan Catalytic προτιμούν χημικά καθαρότερο οξυγόνο.[25]
Χημεία και χημική κινητική της άμεσης οξείδωσης αιθενίου
[Επεξεργασία | επεξεργασία κώδικα]Τυπικά, η μέθοδος της άμεσης μερική οξείδωσης αιθενίου (από οξυγόνο) σε οξιράνιο εκφράζεται με την ακόλουθη στοιχειομετρική εξίσωση: [3]
![]() ΔH = -105 kJ/mole
ΔH = -105 kJ/mole
Ωστόσο, στην πράξη συμπαράγεται σημαντική ποσότητα διοξειδίου του άνθρακα (CO2) και υδρατμών (H2O), που εξηγείται από την ολική οξείδωση μέρους του αιθενίου ή και μέρους του παραγώμενου οξιρανίου:
Η διεργασία της ετερογενούς καταλυτικής οξείδωσης του αιθενίου μελετήθηκε από τους P. A. Kilty και W. M. H. Sachtler, οι οποίοι πρότειναν τον ακόλουθο μηχανισμό:[26]
Σε αυτήν τη διεργασία χρησιμοποιοὐνται 1,2-διχλωραιθάνιο και χλωραιθένιο (CH2=CHCl) ως παρεμποδιστές, για να εμποδίσουν περεταίρω οξείδωση του οξιρανίου επίσης σε διοξείδιο του άνθρακα και υδρατμούς. Εδώ, το χημικά συνδεμένο χλώριο παρεμποδίζει τη διάσπαση του χημκά δεσμευμένου οξυγόνου σε ατομικό οξυγόνο, που είναι υπεύθυνο για τις ανεπιθύμητες αντιδράσεις. Σύμφωνα με τα παραπάνω η συνολική στοιχειομετρική εξίσωση της διεργασίας είναι η ακόλουθη:
Με βάση την παραπάνω στοιχειομετρική εξίσωση προκύπτει ο μέγιστος βαθμός μετατροπής (δηλαδή η μέγιστη απόδοση της μεθόδου), σε 6/7, δηλαδή περίπου 85,7%.[26]
Ο καταλύτης για τη μέθοδο αυτή είναι, όπως προαναφέρθηκε, ο μεταλλικός άργυρος, αλλά ανάλογα με τη χρησιμοποιούμενη παραγωγή μπορεί να έχει αποτεθεί πάνω σε μήτρες διαφόρων υλικών, που συμπεριλαμβάνουν ελαφρόπετρα, γέλη πυριτίας, διάφορα πυριτικά (SiO44-), πυριτικό αργίλιο (Al2SiO5), οξείδιο του αργιλίου (Al2O3) και καρβίδιο του πυριτίου (SiC). Επίσης, χρησιμοποιήθηκαν διάφορα πρόσθετα ως καταλυτικοί ενεργοποιητές. Στους πρόσθετους καταλυτικούς ενεργοποιητές για τη μέθοδο αυτή συμπεριλαμβάνονται το αντιμόνιο, το βισμούθιο, το υπεροξείδιο του βαρίου (BaO2) και άλλα.[27]
Η θερμοκρασία της μεθόδου ρυθμίζεται σε 220–280 °C. Η χρήση χαμηλότερων θερμοκρασιών μειώνει την ενεργότητα του καταλύτη, ενώ οι υψηλότερες θερμοκρασίες αυξάνουν την πλήρη οξείδωση του αιθενίου σε διοξείδιο του άνθρακα και υδρατμούς, μειώνοντας έτσι την απόδοση σε οξιράνιο. Η αυξημένη πίεση, 1–3 MPa, αυξάνει την παραγωγικότητα του καταλύτη, ενώ ταυτόχρονα διευκολύνει την απορρόφηση του παραγώμενου οξιρανίου (και άρα τη σχετική απομάκρυνσή του από τα αντιδρώντα αέρια, για να το προφυλάξει από αλλοίιωση).[27]
Ενώ η οξείδωση από το ατμοσφαιρικό οξυγόνο συνεχίζει να χρησιμοποιείται, η χρήση χημικά καθαρότερου οξυγόνου (χρησιμοποιείται >95% καθαρότητα) προτιμάται από κάποιες εταιρείες για αρκετούς λόγους, όπως η μεγαλύτερη μοριακή απόδοση σε οξιράνιο, η οποία είναι 75-82% για το χημικά καθαρότερο οξυγόνο, έναντι της μοριακής απόδοσης 63-75% για τη χρήση ατμοσφαιρικού οξυγόνου. Επίσης, με τη χρήση χημικά καθαρότερου οξυγόνου ο ρυθμός παραγωγής οξιρανίου είναι υψηλότερος, ενώ δεν με τη χρήση χημικά καθαρότερου οξυγόνου αποφεύγεται η ανάγκη απομάκρυνσης του ατμοσφαιρικού αζώτου, από το προϊόν μείγμα.[10][28]
Επισκόπηση διαδικασίας
[Επεξεργασία | επεξεργασία κώδικα]Η παραγωγή οξιρανίου σε εμπορική κλίμακα επιτυγχάνεται με την ενοποίηση των ακόλουθων μονάδων διεργασιών:
- Κύριος αντιδραστήρας.
- Απορροφητήρας οξιρανίου.
- Απελευθερωτής οξιρανίου.
- Στήλη απογύμνωσης και απόσταξης.
- Απορροφητήρας διοξειδίου του άνθρακα.
- Απελευθερωτής διοξειδίου του άνθρακα.
Κύριος αντιδραστήρας
[Επεξεργασία | επεξεργασία κώδικα]Ο κύριος αντιδραστήρας αποτελείται από χιλιάδες καταλυτικούς σωλήνες σε δέσμες αυτών. Αυτοί οι σωλήνες έχουν γενικά μήκος 6 - 15 μέτρα, με εσωτερική διάμετρο 20 - 50 χιλιοστόμετρα. Ο καταλύτης τοποθετείται σε αυτούς τους σωλήνες με τη μορφή σφαιρών ή δακτυλίων διαμέτρου 3 - 10 χιλιοστόμετρα. Οι συνθήκες λειτουργείας είναι θερμοκρασία 200-300oC και πίεση 1 - 3 MPa. Για τη διατήρηση των παραπάνω θερμοκρασιών, το ψυκτικό σύστημα του αντιδραστήρα παίζει νευραλγικό ρόλο. Με τη «γείρανση» του καταλύτη, η εκλεκτικότητα του αντιδραστήρα μειώνεται, με αποτέλεσμα να έχουμε περισσότερα εξωθερμικά παραπροϊόντα, δηλαδή διοξείδιο του άνθρακα.
Απορροφητήρας οξιρανίου
[Επεξεργασία | επεξεργασία κώδικα]Αφού το αέριο ρεύμα εξέρχεται από τον κύριο αντιδραστήρα, περιέχει οξιράνιο (1–2%) και διοξείδιιο του άνθρακα (5%), ψύχεται. Μετά διέρχεται διαμέσου του απορροφητήρα οξιρανίου. Εδώ χρησιμοποιείται νερό, ως απορροφητικό μέσο, που απορροφά την πλειονότητα του οξιρανίου, μαζί με κάποιες ποσότητες διοξειδίου του άνθρακα, αζώτου, αιθενίου, μεθανίου και κάποιοων αλδεϋδών, που προϋπήρχαν στο ρεύμα ανακύκλωσης ή παρήχθηκαν στον κύριο αντιδραστήρα. Επίσης, ένα μικρό ποσοστό του εισερχόμενου στον απορροφητήρα αερίου οξιρανίου (1 - 2‰) και απομακρύνεται συνεχόμενα (με καύση), για να εμποδιστεί η συσσώρευσή του μαζί με τα (σχετικά) αδρανή συστατικά, όπως άζωτο, αργό και αιθάνιο που βρέθηκαν ως προσμείξεις στα αντιδρώντα.
Απελευθερωτής οξιρανίου
[Επεξεργασία | επεξεργασία κώδικα]Το παραπάνω αναφερώμενο υδάτινο ρεύμα, που είναι προϊόν της παραπάνω αναφερόμενης διεργασίας απορρόφησης, στέλνεται στον απελευθερωτή οξιρανίου. Εκεί, το οξιράνιο παραλαμβάνεται ως επιφανειακό προϊόν με το ρεύμα ανακύκλωσης, ενώ από τις περιοχές του πυθμένα παραλαμβάνεται η αποκαλούμενη «αιμοραγία γλυκόλης» (‘glycol bleed’). Το οξιράνιο απορροφάται ξανά από το ρεύμα ανακύκλωσης σε νέο υδατικό διάλυμα, αλλά αναπόφευκτα συμπαράγονται αιθυλενογλυκόλες (δηλαδή η 1,2-αιθανοδιόλη, η διαιθυλενογλυκόλη και οι άλλες πολυαιθυλενογλυκόλες). Για να αποφευκτεί η συσσώρευσή τους στο σύστημα, απομακρύνονται από τον συνεχώς από τον πυθμένα του απορροφητήρα οξιρανίου.
Στήλη απογύμνωσης και απόσταξης
[Επεξεργασία | επεξεργασία κώδικα]Εδώ το υδατικό ρεύμα οξιρανίου «απογυμνώνεται» (stripped off) πρώτα από τα όποια χαμηλής θερμοκρασίας βρασμού συστατικά παρέμειναν μαζί του (επειδή επίσης είναι ελαφρύτερα από τις αιθυλενογλυκόλες) και μετά αποστάζεται, για να απελευθερωθεί από το νερό στο οποίο ήταν διαλυμένο.
Απορροφητήρας διοξειδίου του άνθρακα
[Επεξεργασία | επεξεργασία κώδικα]Το αέριο ρεύμα ανακύκλωσης, που παραλαμβάνεται από τον κύριο αντιδραστήρα, συμπιέζεται και ένα υπορρεύμα τροφοδοτεί τον απορροφητήρα διοξειδίου του άνθρακα. Εκεί το διοξείδιο του άνθρακα διαλύεται σε θερμό υδατικό διάλυμα ανθρακικού καλίου (K2CO3), που λειτουργεί ως απορροφητικό μέσο για το διοξείδιο του άνθρακα. Η διάλυση διοξειδίου του άνθρακα σε αυτό το μέσο είναι τόσο φυσικό, όσο και χημικό φαινόμενο, γιατί το διοξείδιο του άνθρακα αντιδρά με το ανθρακικό κάλιο (και με το νερό), παράγοντας όξινο ανθρακικό κάλιο (ΚHCO3):
Απελευθερωτής διοξειδίου του άνθρακα
[Επεξεργασία | επεξεργασία κώδικα]Το παραπάνω αναφερώμενο διάλυμα ανθρακικού καλίου, εμπλουτισμένο με το διοξείδιο του άνθρακα που απορρόφησε, στέλνεται στον απελευθερωτή διοξειδίου του άνθρακα, που απελευθερώνει το διοξείδιο του άνθρακα σε δύο (2) βήματα, που εναλλάσσονται. Στο βήμα #1 απομακρύνονται οι αέριοι υδρογονάνθρακες που συναπορροφήθηκαν, ενώ στο βήμα #2 ενεργοποιείται η «απογύμνωση» (strip off) του διοξειδίου του άνθρακα.
Παγκόσμια παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Η παγκόσμια παραγωγή οξιρανίου ήταν 20 εκατομμύρια τόνοι το 2009,[29] 19 εκατομμύρια τόνοι το 2008 και 18 εκατομμύρια τόνοι το 2007.[30]
Το οξιράνιο βρίσκεται στη 14η θέση των περισσότερο παραγώμενων οργανικών χημικών, με πρώτο το αιθένιο, με ετήσια παγκόσμια παραγωγή 113 εκατομύρια τόνους.[31]
Η SRI προέβλεψε αύξηση της ζήτησης οξιρανίου κατά 4,4% ανά έτος για τη χρονική περίοδο 2008 - 2013 και 3% ετησίως για τη χρονική περίοδο 2013 - 2018.[30]
Το 2004, η παγκόσμια παραγωγή οξιρανίου ανά περιοχή ήταν ως ακολούθως[32]
| Περιοχή | Αριθμός μεγάλων παραγωγών | Παραγωγή σε χιλιάδες τόνους |
|---|---|---|
| Βόρεια Αμερική | 16
10 3 3 |
5.443
4.009 1.084 350 |
| Νότια Αμερική | 3
2 1 |
394
312 82 |
| Ευρώπη | 12+
2 1 4 2 1 1 1 όχι δεδομένα |
3.905
770 215 995 460 100 115 300 950 |
| Μέση Ανατολή | 52
1 2 |
2.332
201 350 1.781 |
| Άπω Ανατολή | 16+
όχι δεδομένα 4 2 1 4 1 3 1 |
4.991
1.354 820 488 175 949 385 740 80 |
Εναλλακτικές μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]1. Εναλλακτικά, η οξείδωση μπορεί να γίνει και με αιθανικό υπεροξύ[33]:
2. Τέλος, υπάρχει και η δυνατότητα η οξείδωση του αιθενίου να γίνει από διοξιράνιο:
Από 2-χλωραιθανόλη
[Επεξεργασία | επεξεργασία κώδικα]Με απόσπαση υδροχλωρίου (HCl) από 2-χλωραιθανόλη παράγεται οξιράνιο[33]:
Από μεθανάλη
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση μεθυλενίου σε μεθανάλη παράγεται και οξιράνιο[34]:
- Μεγαλύτερη απόδοση σε οξιράνιο έχει η παραγωγή μεθυλενίου με το σύστημα ψευδαργύρου - διιωδομεθανίου, που ευνοεί την παραγωγή κυκλικών ενώσεων[35]:
Από δι(βρωμομεθυλ)αιθέρα
[Επεξεργασία | επεξεργασία κώδικα]Με τη χρήση ενδομοριακής αντίδρασης Würtz σε δι(βρωμομεθυλ)αιθέρα[36][37]
Όμως η απόδοση αυτής της αντίδρασης είναι σχετικά μικρή, αφού ταυτόχρονα διεξάγεται αναπόφευκτα και διαμοριακή[38]:
Στις μέρες μας χρησιμοποιείται περισσότερο η τροποποιημένη αντίδραση Freund με Zn, που δίνει μεγαλύτερη απόδοση στην ενδομοριακή αντίδραση. Σ' αυτήν την περίπτωση η στοιχειομετρική εξίσωση της αντίδρασης γίνεται[39][40]:
Φυσικές και φασματοσκοπικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Το οξιράνιο είναι αέριο (εννοείται στις συνηθισμένες συνθήκες, γιατί έχει θερμοκρασία βρασμού 10 °C) και έχει διπολική ροπή 1,9 D. Οι αποστάσεις μεταξύ των ατόμων του μορίου του και οι γωνίες των δεσμών του μετρήθηκαν με ακρίβεια με φασματοσκοπία μικροκυμάτων κι έχουν τις ακόλουθες τιμές[14][41]:
Η ενέργεια τάσης δεσμών υπολογίστηκε σε 105 kJ/mol (η αντίστοιχη τιμή για το κυκλοπροπάνιο είναι 117 kJ/mole). Στα φάσματα υπερύθρου η δόνηση του δεσμού C-Η εμφανίζεται στην περιοχή των αντίστοιχων των αλκενίων (>C=CH2), δηλαδή γύρω στα 3050 cm−1, ενώ η δόνηση του δεσμού C-Ο βρίσκεται στην περιοχή των αντίστοιχων των αλκενυλαιθέρων (>C=C-OR), δηλαδή στα 1250 cm−1[33].
Χημική συμπεριφορά και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Το οξιράνιο και τα υπόλοιπα οξιράνια (αλκυλιωμένα παράγωγα του οξιράνιου) χαρακτηρίζονται από αντιδράσεις κυκλοπροσθήκης, δηλαδή προσθήκης στα δυο άκρα μετά από διάνοιξη του δακτυλίου. Αντιδρούν εύκολα με πυρηνόφιλα αντιδραστήρια (π.χ. H-, X-, HO-, RO-, RMgI, NH3, κτλ. που παρακάτω συμβολίζονται γενικά ως ZA), κατά την ακόλουθη γενική αντίδραση:
Οι αντιδράσεις αυτές είναι τύπου SN2 με αντιπροβολή σε σχέση με το οξυγόνο, με σχηματισμό ρακεμικών και διαστερεομερών μειγμάτων. Σε ορισμένα οξιράνια, με υποκαταστάτες ισχυρούς δέκτες ηλεκτρονίων, όπως π.χ. CN, μπορεί να διασπαστεί ο δεσμός C-C, οπότε με αλκένια, παράγονται οξολάνια[42].
Προσθήκη ύδατος
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση ύδατος έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = OH και Z = H. Παράγεται 1,2-αιθανοδιόλη. Τα υδατικά διαλύματα οξιρανίου είναι μάλλον σταθερά και μπορούν να διατηρηθούν για μακρά χρονικά διαστήματα χωρίς εμφανή αντίδραση, αλλά αν προσθέσουμε σ' αυτά έστω και μια μικρή ποσότητα οξέος, π.χ. θεικού οξέος, αρχίζει αμέσως να παράγεται η 1,2-αιθανοδιόλη, ακόμη και σε θερμοκρασία δωματίου (20°C). Η αντίδραση μπορεί επίσης να πραγματοποιηθεί στην αέρια κατάσταση, δηλαδή με επίδραση υδρατμών, παρουσία ενός φωσφορικού άλατος ως καταλύτη.[43]. Η αντίδραση συνήθως πραγματοποίείται γύρω στους 60 °C, με μεγάλη περίσσεια ύδατος, ώστε να παρεμποδιστεί η αντίδραση της παραγώμενης 1,2-αιθαδιόλης με το οξιράνιο που δεν πρόλαβε να αντιδράσει, η οποία αντίδραση θα έδινε 2-(2΄-υδροξυαιθοξυ)αιθανόλη ή και 1,2-δι(2΄-υδροξυαιθοξυ)αιθάνιο [44]:
Προσθήκη υδριδίου του λιθίου
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδριδίου του λιθίου έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = Η και Z = Li. Παράγεται αιθανολικό λίθιο, το οποίο με υδρόλυση δίνει αιθανόλη:
Προσθήκη υδραλογόνου
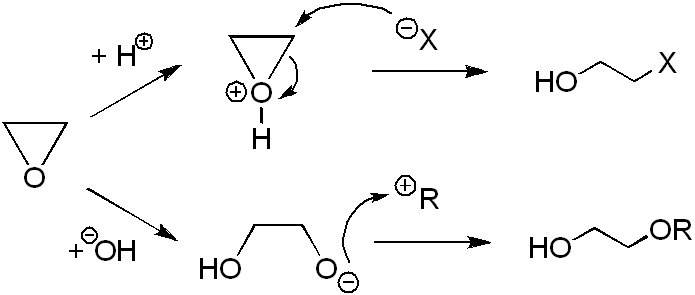
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδραλογόνου (HX, όπου Χ = Cl, Br, I) έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = X και Z = H. Παράγεται 2-αλαιθανόλη (XCH2CH2OH):
- Η 2-φθοραιθανόλη παράγεται με ανάλογη αντίδραση, αλλά με λίγο διαφορετικές συνθήκες: Η επίδραση των άλλων υδραλογόνων γίνεται με υδατικά τους διαλύματα, ενώ αυτή του υδροφθορίου γίνεται από βραστό υδροφθόριο σε διαιθυλαιθέρα που περιέχει 1,5%-2% νερό. Αν χρησιμοποιηθεί τελείως άνυδρος αιθέρας, το οξιράνιο πολυμερίζεται[45].
- Οι 2-αλαιθανόλες μπορούν να παραχθούν επίσης με επίδραση υδατικών διαλυμάτων αλογονούχων μετάλλων σε οξιράνιο. Π.χ. με επίδραση υδατικού διαλύματος διχλωριούχου χαλκού (CuCl2) σε οξιράνιο έχουμε την ακόλουθη αντίδραση[43]:
Προσθήκη υδροκυανίου
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση υδροκυανίου (HCN) έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = CN και Z = H. Παράγεται 3-υδροξυπροπανονιτρίλιο:
- Το ίδιο προϊόν παράγεται και με επίδραση υδατικών διαλυμάτων κυανιούχων αλάτων. Π.χ. με επίδραση κυανιούχου ασβεστίου έχουμε την ακόλουθη αντίδραση[46]:
Προσθήκη αμμωνίας ή αμινών
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση αμμωνίας έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = NH2 και Z = H. Παράγεται 2-αμιναιθανόλη:
- Συμπαράγονται επίσης δι(2-υδροξυαιθυλ)αμίνη και τρι(2-υδροξυαιθυλ)αμίνη:
2. Με επίδραση πρωτοταγούς αμίνης (RNH2) έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = RNH και Z = H. Παράγεται 2-αλκυλαμιναιθανόλη:
3. Με επίδραση δευτεροταγούς αμίνης (R2NH, όπου τα δύο R όχι απαραίτητα ίδια) έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = R2N και Z = H. Παράγεται 2-διαλκυλαμιναιθανόλη:
- Οι παραπάνω αντιδράσεις διεγείρονται με την προσθηκη μικρής ποσότητας ύδατος.
- Επειδή οι παραγόμενες αμιναλκοόλες αντιδρούν επίσης με το οξιράνιο που δεν πρόλαβε να αντιδράσει, συμπαράγονται τα ανάλογα παράγωγα, δηλαδή αμινοπολυαιθυλενογλυκόλες[7]:
4. Με επίδραση υδατικού διαλύματος τριτοταγούς αμίνης (που δρα ως R3NH+OH-, όπου τα τρία R όχι απαραίτητα ίδια) έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = R3N+ και Z = H. Παράγεται υδροξείδιο του (2-υδροξυλαιθυλο)τριαλκυλαμμωνίου[47]:
Προσθήκη καρβοξυλικών οξέων και παραγώγων τους
[Επεξεργασία | επεξεργασία κώδικα]Το οξιράνιο αντιδρά επίσης με καρβοξυλικά οξέα (RCOOH), με την παρουσία ενός καταλύτη, παράγοντας τους αντίστοιχους μονοεστέρες της 1,2-αιθανοδιόλης, ενώ με ανυδρίτες καρβοξυλικών οξέων ((RCO)2O) δίνει τους διεστέερες της 1,2-αιθανοδιόλης:
Τα αμίδια των καρβοξυλικών οξέων (RCONH2) αντιδρούν παρόμοια, παράγοντας τα αντίστοιχα N-(2-υδροξυαιθυλ)αμίδια:
Η κυκλοπροσθήκη ανώτερων καρβοξυλικών οξέων σε οξιράνιο πραγματοποιείται σε (σχετικά) αυξημένες θερμοκρασίες (τυπικά 140–180 °C) και πιέσεις (300–500 kPa), και σε «αδρανή ατμόσφαιρα», υπό την παρουσία ενός αλκαλικού καταλύτη (συγκέντρωσης 0,01–2%), όπως το υδροξείδιο ή ανθρακικό νάτριο ή κάλιο[48]:
Προσθήκη οργανομεταλλικών ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]Η επίδραση του οξιρανίου με οργανομεταλλικές ενώσεις, όπως τα αντιδραστήρια Grignard (RMgX), μπορούν να θεωρηθούν ως μερικές περιπτώσεις της παραπάνω γενικής αντίδρασης, με Z = MgBr και A = R. Μετά και την υδρόλυση του παραγόμενου προϊόντος, το τελικό προϊόν είναι μια πρωτοταγής αλκοόλη. Στην ουσία, η όλη αντίδραση αντιστοιχεί σε ανοικοδόμιση της οργανομεταλλικής ένωσης κατά τα δύο (2) άτομα άνθρακα του οξιρανίου[49]:
Εντελώς παρόμοιες αντιδράσεις έχουμε και για αντιδράσεις οξιρανίου με άλλες οργανομεταλλικές ενώσεις, όπως για παράδειγμα με αλκυλολιθιακές ενώσεις (RLi), που επίσης μπορεί να θεωρηθεί ως μερική περίπτωση της παραπάνω αναφερόμενης γενικής αντίδρασης, με Z = Li και A = R :
Προσθήκη θειούχων ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]1. Όταν αντιδρά υδρόθειο (H2S) με οξιράνιο, έχουμε μερική περίπτωση της παραπάνω γενικής αντίδρασης με Z = Η και A = HS, οπότε παράγεται 2-υδροθειαιθανόλη ή αν το οξιράνιο βρίσκεται σε σχετική περίσσεια, μπορεί να γίνει λίγο η διαφορετική εφαρμογή Z = Η (δις) και A = S, οπότε παράγεται 2-(2-υδροξυαιθυλοθει)αιθανόλη. Τέλος, στην περίπτωση επίδρασης υδατικού διαλύματος υδροθείου σε μεγάλη περίσσεια οξιρανίου παράγεται υδροξείδιο του τρι(2-υδροξυαιθυλο)σουλφωνίου:
2. Στην περίπτωση κυκλοπροσθήκης θειόλης (RSH) σε οξιράνιο, έχουμε μερική περίπτωση της παραπάνω γενικής αντίδρασης Z = Η και A = SR, οπότε παράγεται 2-αλκυλοθειαιθανόλη:
Προσθήκη αλάτων του νιτρώδους οξέος ή νιτρικού οξέος
[Επεξεργασία | επεξεργασία κώδικα]1. Η αντίδραση οξιράνιου με υδατικά διαλύματα αλάτων του νιτρώδους οξέος, όπως νιτρώδες βάριο, νιτρώδες ασβέστιο, νιτρώδες μαγνήσιο ή νιτρώδες νάτριο οδηγεί στο σχηματισμό 2-νιτραιθανόλης[50]. Για παράδειγμα, με νιτρώδες ασβέστιο έχουμε:
2. Αν χρησιμοποιηθεί νιτρικό οξύ, το οξιράνιο δίνει νιτρικούς μονο- ή διεστέρες της 1,2-αιθανοδιόλης[51]:
Προσθήκη αρωματικών ενώσεων
[Επεξεργασία | επεξεργασία κώδικα]Το οξιράνιο εμπλέκεται σε αντιδράσεις Friedel-Crafts με αρωματικές ενώσεις γενικού τύπου ArH. Για παράδειγμα, με το βενζόλιο (PhH) δίνει 2-φαινυλαιθανόλη:
Μετατροπή σε θειιράνιο
[Επεξεργασία | επεξεργασία κώδικα]Το οξιράνιο μπορεί να μετατραπεί σε θειιράνιο, με επίδραση κάποιου θειοκυανιούχου άλατος, όπως το θειοκυανιούχο κάλιο (KSCN). Για το σκοπό αυτό, το θειοκυανιούχο κάλιο πριν από τη χρήση τήκεται υπό κενό, για να αφαιρεθεί από αυτό όλη η υγρασία (που τυχόν) περιέχει[52]:
Εφαρμογές
[Επεξεργασία | επεξεργασία κώδικα]Η κυριότερη εφαρμογή του οξιρανίου είναι η παραγωγή της αιθυλενογλυκόλης. Χρησιμοποιείται επίσης στην παραγωγή αιθυλενογλυκολικών αιθέρων, καθώς επίσης και στην παρασκευή αιθανολαμινών. Οι αιθανολαμίνες χρησιμοποιούνται στην παραγωγή μη ιονικών απορρυπαντικών και υφάνσιμων ινών.
Το οξιράνιο αυτοπολυμερίζεται κατά την παραμονή προς πολυαιθυλενοξείδιο. Το πολυαιθυλενοξείδιο προστίθεται στους πυροσβεστήρες νερού, έτσι ώστε να αυξάνεται η απόσταση εξακοντισμού του νερού.
Το οξιράνιο χρησιμοποιείται επίσης ως απολυμαντικό στα νοσοκομεία και γενικότερα για την αποστείρωση ιατρικών εργαλείων και εξοπλισμού, ως βακτηριοκτόνο και ως παρασιτοκτόνο στη Γεωπονία.
Κίνδυνοι για την υγεία
[Επεξεργασία | επεξεργασία κώδικα]Παρά τη μεγάλη του χρησιμότητα, το οξιράνιο είναι τοξικό και εύφλεκτο και έχει συνδεθεί με κάποια σοβαρά ατυχήματα.
Πέραν του ερεθισμού του αναπνευστικού συστήματος και των οφθαλμών, η έκθεση στο οξιράνιο μπορεί να προκαλέσει δύσπνοια, θολότητα στην όραση, ναυτία, ζάλη και πονοκεφάλους. Προκαλεί επίσης καρκίνο στα ζώα και τους ανθρώπους. Για την προστασία των εργαζομένων, στις ΗΠΑ ορίστηκε ως (μέγιστο) αποδεκτό όριο έκθεσης το 1 ppm οξιρανίου στον αέρα, ως μέσο όρο μετρήσεων κατά τη διάρκεια του οκταώρου.
Μεγάλη προσοχή συνιστάται και λόγω της ευφλεκτότητας του οξιρανίου. Σε καμία περίπτωση δεν πρέπει η θερμοκρασία του να ξεπεράσει τους 560 °C, γιατί θα αυταναφλεγεί, ακόμη και απουσία οξυγόνου.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Παπαγεωργίου, Β.Π., Εφαρμοσμένη Οργανική Χημεία, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 2005, ISBN 960-260-342-7
- Μια ιστοσελίδα αποκλειστικά για το οξιράνιο Αρχειοθετήθηκε 2006-12-07 στο Wayback Machine.
- Πληροφορίες σχετικά με την προστασία των εργαζομένων
- SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
- «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
- Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
- Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ Έκδοση Θεσσαλονίκη 1991
- Νικολάου Ε. Αλεξάνδρου, «Γενική Οργανική Χημεία», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, θεσσαλονίκη 1983
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Δημητρίου Ν. Νικολαΐδη: «Χημεία Ετεροκυκλικών Ενώσεων», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Διαδικτυακοί τόποι που αναφέρονται στις «Αναφορές και παρατηρήσεις».
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Σημείωση #1: Δείτε τις εναλλακτικές ονομασίες στον παρακείμενο πίνακα πληροφοριών χημικής ένωσης.
- ↑ Σημείωση #2. Οι ετεροκυκλικοί αιθέρες ονομάζονται επίσης «εποξείδια».
- ↑ 3,0 3,1 3,2 3,3 Siegfried Rebsdat, Dieter Mayer "Ethylene Oxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. Article Online Posting Date: March 15, 2001.
- ↑ McKetta, John J. and Cunningham, William A. (1984). Encyclopedia of Chemical Processing and Design 20. CRC Press. p. 309. ISBN 0-8247-2470-4.
- ↑ Eric Croddy, James J. Wirtz (2005). Weapons of mass destruction: an encyclopedia of worldwide policy, technology, and history, Volume 2. ABC-CLIO. p. 136. ISBN 1-85109-490-3.
- ↑ Rudolf Meyer, Josef Köhler, Axel Homburg (2007). Explosives. Wiley-VCH. p. 142. ISBN 3-527-31656-6.
- ↑ 7,0 7,1 7,2 PV Zimakova and Ph. O. Dymenta, επιμ. (1967). «Part I. Structure and properties of ethylene oxide. Features of the reactivity of ethylene oxide and the structure of its molecules». Ethylene oxide. Khimiya. σελίδες 15–17.
- ↑ G. Bredig and A. Usoff (1896) "Ist Acetylen ein Elektrolyt?" (Is acetylene an electrolyte?), Zeitschrift für Elektrochemie, 3 : 116-117.
- ↑ Eugen F. von Gorup-Besanez, ed., Lehrbuch der organischen Chemie für den Unterricht auf Universitäten, … [Textbook of Organic Chemistry for Instruction at Universities, … ], 3rd ed. (Braunschweig, Germany: Friedrich Vieweg und Sohn, 1868), vol. 2, page 268. See also p. 253 of the 1876 edition: Eugen F. von Gorup-Besanez, ed., Lehrbuch der organischen Chemie für den Unterricht auf Universitäten, … , 5th ed. (Braunschweig, Germany: Friedrich Vieweg und Sohn, 1876), vol. 2, page 253.
- ↑ 10,0 10,1 Ethylene Oxide". Kirk-Othmer Encyclopedia of Chemical Technology. Elastomers, synthetic to Expert Systems 9 (4 ed.). New York: John Wiley & Sons. 1994. pp. 450–466.
- ↑ Lefort, T.E. (1935). "Process for the production of ethylene oxide. United States Patent 1998878". Retrieved 2009-09-23.
- ↑ P. P. McClellan (1950). "Manufacture and Uses of Ethylene Oxide and Ethylene Glycol". Ind. Eng. Chem. 42 (12): 2402–2407. doi:10.1021/ie50492a013.
- ↑ Knunyants, IL, ed. (1988). "Voltage molecules". Chemical Encyclopedia 3. "Soviet encyclopedia". pp. 330–334.
- ↑ 14,0 14,1 Traven VF (2004). VFTraven, επιμ. Organic chemistry: textbook for schools. 2. ECC "Academkniga". σελίδες 102–106. ISBN 5946281720.
- ↑ Cunningham G. L., Levan W. I., Gwinn W. D. (1948). "The Rotational Spectrum of Ethylene Oxide". Phys. Rev. 74 (10): 1537. doi:10.1103/PhysRev.74.1537.
- ↑ The dipole moments of certain substances". ChemAnalitica.com. 1 April 2009. Retrieved 2009-09-21.
- ↑ Norris, J.F. (1919). «The Manufacture of War Gases in Germany». Journal of Industrial and Engineering Chemistry 11 (9): 817–829. doi:.
- ↑ 18,0 18,1 Weissermel K.· Arpe H-J. (2003). Industrial organic chemistry (4 έκδοση). Weinheim: Wiley-VCH. σελίδες 145–148. ISBN 978-3-527-30578-0.
- ↑ Market Study: Ethylene Αρχειοθετήθηκε 2015-03-07 στο Wayback Machine.. Ceresana.com (December 2010). Retrieved on 2017-05-08.
- ↑ «Process Economics Program Report 2D». PEP Report. SRI Consulting. Φεβρουαρίου 1985. Ανακτήθηκε στις 19 Νοεμβρίου 2009.
- ↑ 21,0 21,1 21,2 21,3 Yukelson I.I. (1968). The technology of basic organic synthesis. Khimiya. σελίδες 554–559.
- ↑ Eley, D.D.· Pines, H.· Weisz, P.B., επιμ. (1967). «Catalitic Oxidation of Olefins». Advances in catalysis and related subjects. 17. New York: Academic Press Inc. σελίδες 156–157.
- ↑ 23,0 23,1 Bloch H. P.· Godse A. (2006). Compressors and modern process applications. John Wiley and Sons. σελίδες 295–296. ISBN 978-0-471-72792-7.
- ↑ 24,0 24,1 «Ethylene Oxide/Ethylene Glycol Process». Process Licensing and Engineering. Scientific Design Company. Αρχειοθετήθηκε από το πρωτότυπο στις 16 Ιουλίου 2011. Ανακτήθηκε στις 3 Οκτωβρίου 2009.
- ↑ Chauvel A.· Lefebvre G. (1989). Petrochemical processes 2. Major Oxygenated, Chlorinated and Nitrated Derivatives. 2 (2 έκδοση). Paris: Editions Technip. σελ. 4. ISBN 2-7108-0563-4.
- ↑ 26,0 26,1 Kilty P. A.; Sachtler W. M. H. (1974). «The mechanism of the selective oxidation of ethylene to ethylene oxide». Catalysis Reviews: Science and Engineering 10: 1–16. doi:.
- ↑ 27,0 27,1 Lebedev, N.N. (1988). Chemistry and technology of basic organic and petrochemical synthesis (4 έκδοση). Khimiya. σελίδες 420–424. ISBN 5-7245-0008-6.
- ↑ Gunardson H. (1998). Industrial gases in petrochemical processing. New York: Marcel Dekker, Inc. σελίδες 131–132. ISBN 0-8247-9908-9.
- ↑ Chemical Weekly, 26 January 2010
- ↑ 30,0 30,1 «Ethylene Oxide». WP Report. SRI Consulting. Ιανουαρίου 2009. Ανακτήθηκε στις 29 Σεπτεμβρίου 2009.
- ↑ «Ethylene». WP Report. SRI Consulting. Ιανουαρίου 2009. Ανακτήθηκε στις 29 Σεπτεμβρίου 2009.
- ↑ «Vol. 97. 1,3-Butadiene, Ethylene Oxide and Vinyl Halides (Vinyl Fluoride, Vinyl Chloride and Vinyl Bromide)». IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Lyon: International Agency for Research on Cancer. 2008. σελίδες 185–287. ISBN 978-92-832-1297-3. Αρχειοθετήθηκε από το πρωτότυπο στις 25 Δεκεμβρίου 2016. Ανακτήθηκε στις 4 Οκτωβρίου 2017.
- ↑ 33,0 33,1 33,2 Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 15.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 138, §9.2Β5β.
- ↑ August Freund (1881). "Über Trimethylen". Journal für Praktische Chemie 26 (1): 625–635. doi:10.1002/prac.18820260125.
- ↑ August Freund (1882). "Über Trimethylen". Monatshefte für Chemie 3 (1): 625–635. doi:10.1007/BF01516828.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2.
- ↑ G. Gustavson (1887). "Ueber eine neue Darstellungsmethode des Trimethylens". J. Prakt. Chem. 36: 300–305. doi:10.1002/prac.18870360127. http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f308.table.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 154, §6.5.Β1.
- ↑ Knunyants, IL, επιμ. (1988). «Voltage molecules». Chemical Encyclopedia. 3. "Soviet encyclopedia". σελίδες 330–334.
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17.
- ↑ 43,0 43,1 PV Zimakova and Mr. O. Dymenta, επιμ. (1967). «Chapter III. Review of the individual reactions of ethylene oxide». Ethylene oxide. M.: Khimiya. σελίδες 90–120.
- ↑ «Epoxyethane (Ethylene Oxide)». Alkenes menu. Chemguide. Ανακτήθηκε στις 5 Οκτωβρίου 2009.
- ↑ William A. Sheppard, Clay M. Sharts (1969). Organic Fluorine Chemistry. W.A. Benjamin. σελ. 98. ISBN 0805387900.
- ↑ «Ethylene cyanohydrin». Organic Syntheses 1: 256. 1941. Αρχειοθετήθηκε από το πρωτότυπο στις 2011-08-21. https://www.webcitation.org/615s2h2Ko?url=http://www.orgsyn.org/orgsyn/pdfs/cv1p0256.pdf. Ανακτήθηκε στις 2011-08-25.
- ↑ Petrov, AA, Balian HV, Troshchenko AT (2002). «Chapter 12. Amino alcohol». Στο: Stadnichuk, επιμ. Organic chemistry (5 έκδοση). St. Petersburg. σελ. 286. ISBN 5819400674.
- ↑ van Os, N. M., ed. (1998). Nonionic surfactants: organic chemistry. CRC Press. pp. 129–131. ISBN 978-0-8247-9997-7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.198, §8.2.7.
- ↑ 2-Nitroethanol". Organic Syntheses 5: 833. 1973.
- ↑ Orlova, EY (1981). Chemistry and technology of high explosives: Textbook for high schools (3 ed.). Khimiya. p. 278.
- ↑ Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Δημητρίου Ν. Νικολαΐδη: «Χημεία Ετεροκυκλικών Ενώσεων», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985, §2.2., σελ. 20




![{\displaystyle \mathrm {CH_{2}=CH_{2}+{\frac {1}{2}}O_{2}{\xrightarrow[{2-3MPa,\;200-300^{o}C}]{Ag}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/94a59eb3217a5152e2fb0e4aba1f4087798f4baf)




































![{\displaystyle \mathrm {+R_{3}N+H_{2}O{\xrightarrow {}}[R_{3}NCH_{2}CH_{2}OH]^{+}OH^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/99d6c20484b314571f7941c40f714d74c9b57bb6)










![{\displaystyle \mathrm {+{\frac {1}{3}}H_{2}S+{\frac {1}{3}}H_{2}O{\xrightarrow {}}{\frac {1}{3}}[(HOCH_{2}CH_{2})_{3}S]OH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0585a5e9a92c02b3562a475be702013217b57422)




