1-φθοροπροπένιο

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | 1-φθοροπροπένιο | ||
| Άλλες ονομασίες | προπεν-1-υλοφθορίδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H5F | ||
| Μοριακή μάζα | 60,0702 amu[1] | ||
| Σύντομος συντακτικός τύπος |
CH3CH=CHF | ||
| Συντομογραφίες | MeCH=CHF | ||
| Αριθμός CAS | E,Z:406-33-7 E:19184-10-2 | ||
| SMILES | CC=CF | ||
| InChI | InChI=1S/C3H5F/c1-2-3-4/h2-3H,1H3 | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | 3 ισοπροπενυλοφθορίδιο αλλυλοφθορίδιο κυκλοπροπυλοφθορίδιο | ||
| Γεωμετρικά ισομερή | 2 | ||
| Φυσικές ιδιότητες | |||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το 1-φθοροπροπένιο[2][3] είναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και φθόριο, με χημικό τύπο C3H5F, αλλά συνήθως αποδίδεται με το σύντομο συντακτικό τύπο CH3CH=CHF. Ανήκει στα αλκενυλοαλογονίδια, δηλαδή στα άκυκλα μονοακόρεστα, δηλαδή με ένα διπλό δεσμό, οργανομονοαλογονίδια. Έχει τα ακόλουθα τρία (3) ισομερή θέσης:
Ονοματολογία
[Επεξεργασία | επεξεργασία κώδικα]Η ονομασία «1-φθοροπροπένιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα: Η ονομασία διαιρείται σε δύο (2) κύρια τμήματα: Το δεξί τμήμα αναφέρεται στη δομή της «κύριας ανθρακικής» αλυσίδας που φέρει την «κύρια χαρακτητιστική ομάδα», εφόσον υπάρχει και προβλέπεται γι' αυτήν χαρακτηριστική κατάληξη, ενώ το αριστερό στους «υποκαταστάτες» (δηλαδή τυχόν «δευτερεύουσες χαρακτηριστικές ομάδες» ή και κύριες χαρακτηριστικές ομάδες για τις οποίες δεν έχουν προβλεδθεί χαρακτηριστικές καταλήξεις) ή και τις «διακλαδώσεις» (δηλαδή τυχόν δευτερεύουσες ανθρακικές αλυσίδες). Στη συγκεκριμένη ένωση, υπάρχει το αρχικό πρόθεμα «φθορ(ο)-» που δηλώνει την ύπαρξη ενός (1) ατόμου φθορίου, ως κύριας χαρακτηριστικής ομάδας αλλά χωρίς προβλεπόμενη κατάληξη, που συγκεκριμένα είναι συνδεμένο στο #1 άτομο της κύριας ανθρακικής αλυσίδας («1-») Ως προς το τμήμα που αφορά την κύρια ανθρακική αλυσιδα ισχύουν τα ακόλουθα: το πρόθεμα «προπ-» δηλώνει την παρουσία τριών (3) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-εν-» δείχνει την παρουσία ενός (1) διπλού δεσμού μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει κύρια χαρακτηριστική ομάδα και προβλεπόμενη χαρακτηριστική κατάληξη. Ο αριθμός θέσης του δεσμού (-1-), στην αρχή του τμήματος της κύριας ονομασίας, παραλήπεται ως πλεονασμός, γιατί οι πολλαπλοί δεσμοί προηγούνται των αλογόνων ως προς την προτεραιότητα αρίθμησης.
Μοριακή δομή
[Επεξεργασία | επεξεργασία κώδικα]| Δεσμοί | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-F | σ | 2sp2-2sp3 | 129 pm | 43% C+ F- |
| C#1,#2-H | σ | 2sp2-1s | 99 pm | 3% C- H+ |
| C=C | σ | 2sp2-2sp2 | 134 pm | |
| π | 2p-2p | |||
| C-C | σ | 2sp3-2sp2 | 144 pm | |
| C#3-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| F | -0,43 | |||
| C#3 | -0,09 | |||
| C#2 | -0,03 | |||
| Η (C-H) | +0,03 | |||
| C#1 | +0,40 | |||
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Με απόσπαση υδραλογόνου
[Επεξεργασία | επεξεργασία κώδικα]Με απόσπαση ενός ατόμου υδραλογόνου από 1-αλο-1-φθοροπροπάνιο, με καλύτερα αποτελέσματα αν το άλλο αλογόνο δεν είναι κι εκείνο φθόριο, παράγεται 1-φθοροπροπένιο[4]:
Με απόσπαση αλογόνου
[Επεξεργασία | επεξεργασία κώδικα]Με απόσπαση αλογόνου (X2) από 1,2-διαλο-1-φθοροπροπάνιο παράγεται 1-φθοροπροπένιο. Καλύτερη απόδοση αν τα άλλα αλογόνα δεν είναι κι εκείνα φθόριο[5]:
Με μερική καταλυτική υδρογόνωση
[Επεξεργασία | επεξεργασία κώδικα]1. Με μερική καταλυτική υδρογόνωση 1-φθοροπροπινίου παράγεται E-1-φθοροπροπένιο[6]
2. Με λίγο διαφορετική μερική υδρογόνωση 1-φθοροπροπινίου παράγεται Z-1-φθοροπροπένιο:
Από 1-χλωροπροπένιο
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση φθοριούχου υφυδραργύρου (Hg2F2) σε 1-χλωροπροπένιο παράγεται 1-φθοροπροπένιο[7]:
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]- Παρέχει δυνατότητες προσθήκης στο διπλό του δεσμό, όσο και προσθήκης ή απόσπασης με το αλογόνο του, αν και το οποίο είναι το χειρότερο για τέτοιες αντιδράσεις.
- Σε περίπτωση προσθήκης, το αρνητικότερο τμήμα της προσθηκόμενης ένωσης, προσελκύτεαι στο άτομο άνθρακα #1, λόγω της παρουσίας του ηλεκτραρνητικού φθορίου δημιουργείται μερικό θετικό φορτίο στο άτομο άνθρακα.
Αντιδράσεις προσθήκης στο διπλό δεσμό
[Επεξεργασία | επεξεργασία κώδικα]Ενυδάτωση
[Επεξεργασία | επεξεργασία κώδικα]1. Επίδραση θειικού οξέος και στη συνέχεια νερού (ενυδάτωση). Παράγεται προπανάλη[8]:
- Αρχικά παράγεται 1-φθοροπροπανόλη-1 που αφυδροφθοριώνεται παράγοντας προπεν-1-όλη-1, η οποία τελικά ισομερειώνεται σε προπανάλη.
2. Υδροβορίωση και στη συνέχεια επίδραση με υπεροξείδιο του υδρογόνου. Παράγεται τρι(1-μεθυλο-2-φθοροαιθυλο)βοράνιο και στη συνέχεια 1-φθοροπροπανόλη-2[9]:
- Προσθήκη διβορανίου έχει το ίδιο αποτέλεσμα.
3. Αντίδραση με οξικό υδράργυρο και έπειτα αναγωγή, αρχικά παράγεται 1-φθοροπροπανόλη-1 που αφυδροφθοριώνεται παράγοντας προπεν-1-όλη-1, η οποία τελικά ισομερειώνεται σε προπανάλη:
4. Υπάρχει ακόμη η δυνατότητα αλλυλικής υδροξυλίωσης κατά Prins με επίδραση αλδευδών ή κετονών σε προπενυλοφθορίδιο απουσία νερού. Π.χ. με μεθανάλη προκύπτει 2-φθοροβουτεν-2-όλη-1:
Προσθήκη υποαλογονώδους οξέως
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε προπενυλοφθορίδιο παράγεται 2-αλοπροπανάλη[10]:
- Το HOX παράγεται συνήθως επιτόπου με την αντίδραση:
- Αρχικά παράγεται 2-αλο-1-φθοροπροπανόλη που αφυδροφθοριώνεται παράγοντας 2-αλοπροπεν-1-όλη-1, η οποία τελικά ισομερειώνεται σε 2-αλπροπανάλη.
Καταλυτική υδρογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Με καταλυτική υδρογόνωση προπενυλοφθορίδιου σχηματίζεται 1-φθοροπροπάνιο. Π.χ.[11]:
Αλογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση αλογόνου (X2) (αλογόνωση) σε προπενυλοφθορίδιο έχουμε προσθήκη στο διπλό δεσμό. Παράγεται 1,2-διαλο-1-φθοροπροπάνιο. Π.χ.[12]:
Υδραλογόνωση
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε προπενυλοφθορίδιο παράγεται 1-αλο-1-φθοροπροπάνιο[13]:
Υδροκυάνωση
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη υδροκυανίου (HCN) (υδροκυάνωση) σε προπενυλοφθορίδιο παράγεται 2-φθοροβουτανονιτρίλιο:
Καταλυτική φορμυλίωση
[Επεξεργασία | επεξεργασία κώδικα]Με προσθήκη μεθανάλης (CO + H2) σε προπενυλοφθορίδιο παράγεται μίγμα 2-φθοροβουτανάλης και μεθυλο-3-φθοροπροπανάλης. Π.χ.:
- Τα παραπάνω μέταλλα που αναφέρονται στη θέση του καταλύτη χρησιμοποιούνται με τη μορφή συμπλόκων τους και όχι σε μεταλλική μορφή.
- Όπου . Εξαρτάται από την επιλογή του καταλύτη. Οι σχετικά ογκώδεις καταλύτες ευνοούν το δεύτερο παραγωγο.
Διυδροξυλίωση
[Επεξεργασία | επεξεργασία κώδικα]Η διυδροξυλίωση προπενίου, αντιστοιχεί σε προσθήκη H2O2[14]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου. Παράγει υδροξυπροπανόνη:
2. Επίδραση καρβονικού οξέος και υπεροξείδιου του υδρογόνου. Παράγει υδροξυπροπανόνη:
3. Μέθοδος Sharpless. Παράγει υδροξυπροπανόνη:
4. Μέθοδος Woodward. Παράγει υδροξυπροπανόνη:
- Στις μεθόδους 1-4 παράγεται αρχικά 1-φθοροπροπανοδιόλη-1,2 που αφυδροφθοριώνεται σχηματίζοντας προπεν-1-οδιόλη-1,2 που με τη σειρά της ισομερειώνεται σε υδροξυπροπανόνη.
5. Υπάρχει ακόμη δυνατότητα για 1,3-διυδροξυλίωση με επίδραση αλδευδών ή κετονών σε προπενυλοφθορίδιο, παρουσία νερού. Αντίδραση Prins. Π.χ. με μεθανάλη παράγεται 2-φθοροβουτανοδιόλη-1,3:
Οζονόλυση
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση όζοντος (οζονόλυση) σε προπενυλοφθορίδιο, παράγεται ασταθές οζονίδιο που τελικά διασπάται σε αιθανάλη και φορμυλοφθορίδιο[15]:
Επίδραση πυκνού υπερμαγγανικού καλίου
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση πυκνού διαλύματος υπερμαγγανικού καλίου (KMnO4) παράγονται αιθανικό οξύ και διοξείδιο του άνθρακα[16]:
Προσθήκη αλδεΰδών ή κετονών κατά Prins
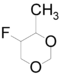
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση περίσσειας αλδευδών ή κετονών σε προπενυλοφθορίδιο-1 απουσία νερού, σε χαμηλή θερμοκρασία παράγεται παράγωγο διοξανίου. Π.χ. με μεθανάλη παράγεται σχεδόν ισομοριακό μίγμα 5-μεθυλο-4-φθορο-1,3-διοξάνιου και 4-μεθυλο-5-φθορο-1,3-διοξάνιου:
Αντίδραση Diels–Adler
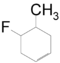
[Επεξεργασία | επεξεργασία κώδικα]Κατά την επίδραση αλκαδιενίου (διένιου) σε προπενυλοφθορίδιο-1 (διενόφιλο) έχουμε την ονομαζόμενη (αντίδραση Diels–Adler) που οδηγεί σε παραγωγή παραγώγου κυκλοεξενίου. Π.χ. με βουταδιένιο-1,3 παίρνουμε σχεδόν ισομοριακό μίγμα 4-μεθυλο-5-φθοροκυκλοεξένιου και 5-μεθυλο-4-φθοροκυκλοεξένιου[17]:
Αντίδραση Pauson-Khand
[Επεξεργασία | επεξεργασία κώδικα]Κατά την επίδραση αλκίνια και μονοξειδίου του άνθρακα σε προπενυλοφθορίδιο-1 έχουμε την ονομαζόμενη αντίδραση Pauson-Khand που στην περίπτωση αυτή οδηγεί σε παραγωγή παραγώγων κυκλοπεντόνης. Π.χ. με αιθίνιο παράγεται 4-μεθυλο-5-φθοροκυκλοπεντεν-2-όνη και 5-μεθυλο-4-φθοροκυκλοπεντεν-2-όνη:
Καταλυτική προσθήκη οξυγόνου
[Επεξεργασία | επεξεργασία κώδικα]Κατά την καταλυτική προσθήκη οξυγόνου σε προπένιο σχηματίζεται 3-μεθυλο-2-φθοροοξιράνιο. Π.χ.:
Πολυμερισμός
[Επεξεργασία | επεξεργασία κώδικα]Διακρίνονται τα ακόλουθα είδη πολυμερισμού προπενυλοφθορίδιο-1, που όλα παράγουν πολυπροπυλοφθορίδιο (PPF)[18]:
1. Κατιονικός. Π.χ.:
2.. Ελευθέρων ριζών. Π.χ.:
- Όπου v ο βαθμός πολυμερισμού.
Αντιδράσεις υποκατάστασης του φθορίου
[Επεξεργασία | επεξεργασία κώδικα]Υποκατάσταση από υδροξύλιο
[Επεξεργασία | επεξεργασία κώδικα]Υδρόλυση με διάλυμα υδροξειδίου του αργύρου (AgOH) προς προπανάλη[19]:
- Αρχικά σχηματίζεται προπεν-1-όλη-1 που ισομερειώνεται προς προπανάλη.
Υποκατάσταση από αλκοξύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με αλκοολικά άλατα (RONa) προς αλκυλοπροπεν-1-υλαιθέρα [19]:
Υποκατάσταση από αλκινύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με αλκινικά άλατα (RC≡CNa) προς αλκενίνιο (RC≡CCH=CHCH3). Π.χ.[19]:
Υποκατάσταση από ακύλιo
[Επεξεργασία | επεξεργασία κώδικα]Με καρβονικά άλατα (RCOONa) προς καρβονικό προπεν-1-υλεστέρα (RCOOCH=CHCH3)[19]:
Υποκατάσταση από κυάνιο
[Επεξεργασία | επεξεργασία κώδικα]Με κυανιούχο νάτριο (NaCN) προς βουτεν-1-νιτρίλιο (CH3CH=CHCN)[19]:
Υποκατάσταση από αλκύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με αλκυλολίθιο (RLi) προς αλκένιο[19]:
Υποκατάσταση από σουλφυδρύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με όξινο θειούχο νάτριο (NaSH) προς προπανοθειάλη (CH3CH2CHS)[19]:
- Αρχικά παράγεται προπενοθειόλη που ισομερειώνεται προς προπανοθειάλη.
Υποκατάσταση από αλκυλοσουλφύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με θειολικό νάτριο (RSNa) προς αλκυλπροπεν-1-υλοθειαιθέρα (RSCH=CHCH3)[19]:
Υποκατάσταση από νιτροομάδα
[Επεξεργασία | επεξεργασία κώδικα]Με νιτρώδη άργυρο (AgNO2) προς 1-νιτροπροπένιο (CH2=CHNO2)[20]:
Υποκατάσταση από φαινύλιο
[Επεξεργασία | επεξεργασία κώδικα]Με βινυλίωση κατά Friedel-Crafts βενζολίου πσράγεται 1-φαινυλοπροπένιο:
Υποκατάσταση από μέταλλα
[Επεξεργασία | επεξεργασία κώδικα]1. Με λίθιο (Li). Παράγεται προπεν-1-υλολίθιο:
2. Με μαγνήσιο (Mg) (αντιδραστήριο Grignard)[21]:
Απόσπαση του υδροφθορίου
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση διαλύματος υδροξειδίου του νατρίου (NaOH) σε αλκοόλη αφυδροφθοριώνεται προς προπίνιο[4]:
Προσθήκη καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]Κατά την προσθήκη μεθυλενίου σε 1-φθοροπροπένιο σχηματίζεται μίγμα από 1-φθορο-1-βουτένιο, 2-φθορο-2-βουτένιο, 1-φθορομεθυλοπροπένιο και μεθυλο-1-φθοροκυκλοπροπάνιο.[22]
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- Παρεμβολή στους τρεις (3) δεσμούς CH2-H: Παράγεται 1-φθορο-1-βουτένιο, ένα αλκενυλαλογονίδιο.
- Παρεμβολή στον (1) δεσμό C#1-H: Παράγεται 2-φθορο-2-βουτένιο, ένα αλκενυλαλογονίδιο.
- . Παρεμβολή στον (1) δεσμό C#2-H: Παράγεται μεθυλο-1-φθοροπροπένιο, ένα αλκενυλαλογονίδιο.
- Προσθήκη στον ένα (1) διπλό δεσμό: Παράγεται 2-μεθυλο-1-φθοροκυκλοπροπάνιο, ένα κυκλοαλκυλαλογονίδιο.
Προκύπτει επομένως μίγμα 1-φθορο-1-βουτενίου ~33%, 2-φθορο-2-βουτενίου ~17%, μεθυλo-1-φθοροοπροπένιου ~17% και μεθυλο-1-φθοροκυκλοπροπάνιου ~17%.
- Με τη χρήση διιωδομεθάνιου (CH2I2) και ψευδαργύρου (Zn) επικρατεί η προσθήκη, οπότε είναι:
Σημειώσεις και αναφορές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Δικτυακός τόπος NIST
- ↑ Για την ακρίβεια, πρόκειται για δύο (2) γεωμετρικά ισομερείς χημικές ενώσεις με επίσημες ονομασίες Ε-1-φθοροπροπένιο, όπου το E-ισομερές δηλώνεται και με το πρόθεμα cis-, και Ζ-1-φθοροπροπένιο, όπου το Z-ισομερές δηλώνεται και με το πρόθεμα trans-). Ωστόσο το μίγμα τους έχει δικό του αριθμό CAS, όπως και το καθένα από τα δύο γεωμετρικά ισομερή ξεχωριστά.
- ↑ Για εναλλακτικές ονομασίες και συμβολισμούς δείτε τον πίνακα πληροφοριών.
- ↑ 4,0 4,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.158, §6.9.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.10.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.10.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.11.
- ↑ 19,0 19,1 19,2 19,3 19,4 19,5 19,6 19,7 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 186, §7.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244, §10.3.Α, R = CH3CH=CH, X = F.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5, R = CH3CH=CH, X = F.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7., σελ. 155, §6.7.3, R = CH3CH=CF ή CH3C=CHF ή CH2CΗ=CHF
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982

![{\displaystyle \mathrm {\mathrm {CH_{3}CH_{2}CHXF+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{3}CH=CHF+NaX} } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7bc79cb2703c74ad7015432a2023340ca2430eb5)




![{\displaystyle \mathrm {CH_{3}CH=CHF+H_{2}SO_{4}{\xrightarrow {}}CH_{3}CH_{2}CH(F)OSO_{3}H{\xrightarrow[{-H_{2}SO_{4}}]{+H_{2}O}}CH_{3}CH_{2}CH(F)OH{\xrightarrow {-HF}}CH_{3}CH=CHOH{\xrightarrow {}}CH_{3}CH_{2}CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0650b90c43f29a1db06cdad6eb33fc646d55c7a6)
![{\displaystyle \mathrm {CH_{3}CH=CHF+BH_{3}{\xrightarrow {}}FCH_{2}CH(BH_{2})CH_{3}{\xrightarrow {+CH_{3}CH=CHF}}[FCH_{2}CH(CH_{3})]_{2}BH{\xrightarrow {+CH_{3}CH=CHF}}[FCH_{2}CH(CH_{3})]_{3}B{\xrightarrow {+3H_{2}O_{2}}}3FCH_{2}CH(OH)CH_{3}+H_{3}BO_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/576d4605bdbdae93ca2eeb686e91f427c6836ad2)
![{\displaystyle \mathrm {CH_{3}CH=CHF+(CH_{3}COO)_{2}Hg+H_{2}O{\xrightarrow[{-CH_{3}COOH}]{Et_{2}O}}CH_{3}COOHgCH(CH_{3})CH(F)OH{\xrightarrow[{}]{+NaBH_{4}+NaOH}}CH_{3}CH_{2}CH(F)OH+Hg+CH_{3}COONa+Na[BH_{3}OH]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f88885c5bc09e988058bea9f3ac519cae96653a1)








![{\displaystyle \mathrm {CH_{3}CH=CHF+CO+H_{2}{\xrightarrow[{10-100\;atm,40^{o}C-100^{o}C}]{Co\;{\acute {\eta }}\;Rh}}xCH_{3}CH_{2}CH(F)CHO+(1-x)FCH_{2}CH(CH_{3})CHO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e2874939e3c315336237ab476211ddabcee5f76f)
![{\displaystyle \mathrm {x\in [0,1]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0071b94225d029fe1a86257743a800e11207d6eb)



![{\displaystyle \mathrm {CH_{3}CH=CHF+OsO_{4}+2H_{2}O+2KOH{\xrightarrow {}}CH_{3}CH(OH)CH(F)OH+K_{2}[OsO_{2}(OH)_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/94a6760d7065c913790e01c20fe37867abd507b1)


![{\displaystyle \mathrm {CH_{3}CH=CHF+{\frac {2}{3}}O_{3}{\xrightarrow[{Zn}]{H_{2}O}}CH_{3}CHO+HCOF} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/3afd8fbcccc7af620f4de5040cfcca0c5e870f6d)

![{\displaystyle \mathrm {CH_{3}CH=CHF+2HCHO{\xrightarrow[{\chi \alpha \mu \eta \lambda {\acute {\eta }}\;\theta \epsilon \rho \mu o\kappa \rho \alpha \sigma {\acute {\iota }}\alpha }]{H_{2}SO_{4}}}{\frac {1}{2}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/542a762a481c14240fcaac372fd32ccb055046ca)







![{\displaystyle \mathrm {CH_{3}CH=CHF+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/93faf6d18e6951a39a377a55c37de1ef04ae80b9)
![{\displaystyle \mathrm {vCH_{3}CH=CHF{\xrightarrow {H^{+}}}[-CH(CH_{3})CHF-]_{v}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce40bcf74ec81dda0da5fa7bde27714160fec1e2)
![{\displaystyle \mathrm {vCH_{3}CH=CHF{\xrightarrow {ROOR}}[-CH(CH_{3})CHF-]_{v}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/75c2a6c13227e77438e5f3da8e66225ea1879da9)












![{\displaystyle \mathrm {CH_{3}CH=CHF+NaOH{\xrightarrow[{\triangle }]{ROH}}CH_{3}C\equiv CH+NaF+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6982917d7a2456208cfef749e0dd5573523bb169)


